PAION Die Fledermaus im Steigflug
Moderation
Zeitpunkt: 16.04.14 12:23
Aktionen: Löschung des Beitrages, Threadtitel trotzdem anzeigen
Kommentar: Urheberrechtsverletzung, vollständige Quellenangabe fehlt
Zeitpunkt: 16.04.14 12:23
Aktionen: Löschung des Beitrages, Threadtitel trotzdem anzeigen
Kommentar: Urheberrechtsverletzung, vollständige Quellenangabe fehlt
Daher meine Bewertung schriftlich:
Danke & finde ich klasse, dass Du eine Zusammenfassung begonnen hast, denn die erleichtert den Überblick zu behalten :-)
***** Deine Informationen haben ein 5-Sterne-Niveau.
Danke dafür & viele Grüße
Sky
Wachstumsfaktor für Gliazellen (GGF2) - Herzinsuffizienz
Der Wachstumsfaktor 2 für Gliazellen (GGF2) ist dafür bekannt, das Wachstum und die Differenzierung einer großen Auswahl von Zellen einschließlich von Gliazellen zu stimulieren, dem Stützgerüst für die Nervenzellen. Die Gliazellen bilden die Myelin-Schicht, die die Nervenzellen abschirmt, und sind essentiell für die Funktion und das Überleben der Nervenzellen. Bei demyelinisierenden Erkrankungen wie Multiple Sklerose wird die Myelin-Schicht beschädigt, was zu einer Degeneration der Nervenzellen führt. In präklinischen Studien, die von PAIONs Entwicklungspartner Acorda, US, durchgeführt wurden, konnte gezeigt werden, dass GGF2 das nötige Zellwachstum stimulieren kann, um die Myelin-Schicht zu schützen und zu erneuern. GGF2 ist das wichtigste Neuroregulin in Acordas Portfolio. Neuroreguline konnten ebenfalls die Fähigkeit zeigen, bei Herzverinsuffizienz ausgelöst durch Herzinfarkte, Herzrhythmusstörungen sowie Herzmuskelerkrankungen in präklinischen Modellen die Herzfunktion wiederherzustellen.
Der Anfang 2010 von Acorda eingereichte IND-Antrag für die Indikation "Herzinsuffizienz" wurde von der FDA genehmigt. Das US-amerikanische NHLB-Institut (National Heart, Lung, and Blood Institute) hat Acorda und seinem Partner Vanderbilt University Heart and Vascular Institute eine Förderung in Höhe von USD 1 Mio. des Cardiac Translational Research Implementation Programms (C-TRIP) für die frühe klinische Entwicklung von GGF2 zugesprochen. Anfang März 2013 hat Acorda positive Ergebnisse der Phase-I-Studie mit GGF2 bekannt gegeben. Die Studie identifizierte eine maximal tolerierte Dosis von GGF2. Die vorläufigen Wirksamkeitsuntersuchungen zeigten, dass GGF2 die Herzfunktion verbessert. Acorda hat die Ergebnisse der Studie mit der FDA diskutiert und eine Einigung über die nächste klinische Studie mit GGF2 bei Herzinsuffizienz erzielt. Diese Phase-Ib-Studie wird in erster Linie weiter das Sicherheitsprofil, aber auch die Wirksamkeit von GGF2 in einer Bandbreite von Dosierungen untersuchen und der Start wurde durch Acorda am 8. Oktober 2013 bekannt gegeben. Die FDA hat GGF2 den „Fast Track“-Status bei der Behandlung von Herzinsuffizienz zuerkannt.
Paion legt seinen Fokus und alle Ressourcen im Augenblick auf Remimazolam. GGF2 ist an Acorda auslizensiert, die auch alle weiteren Kosten für die zukünftige Entwicklung tragen. GGF2 wird noch in mehreren Indikationen, teilweise mit Blockbusterpotenzial zur Auslizensierung angeboten. Bis zur evtl. Zulassung stehen Paion hier Milestones in Höhe von etwa 7,5 Millionen $ zu. Danach sind dann umsatzabhängige Zahlungen ausgehandelt.
Paion Homepage:
http://www.paion.de/
Erbse's Paion Recherche Board
http://www.ep.vm-elsig.de/yabb2/YaBB.pl
PAION AG BERICHTET DIE WESENTLICHEN STUDIENDATEN VON ONOS
PHASE-II/III-STUDIE - REMIMAZOLAM ERREICHT PRIMÄRES STUDIENZIEL UND ZEIGT
GUTE SICHERHEITSDATEN
- Abschluss der Phase-II/III-Studie mit 375 Patienten
- Primäres Studienziel erfolgreich erreicht
- Ausgezeichnete Herz-Kreislauf-Stabilität bestätigt
- Gutes Sicherheitsprofil von Remimazolam bestätigt
Aachen, 14. November 2013 - Das biopharmazeutische Unternehmen PAION AG
(ISIN DE000A0B65S3; Frankfurter Wertpapierbörse, General Standard: PA8)
gibt heute bekannt, dass sein Partner Ono Pharmaceutical Co., Ltd. ('Ono')
die PAION AG darüber informiert hat, dass die klinische Phase-II/III-Studie
mit Remimazolam (Entwicklungscode ONO-2745/CNS 7056) in der Leitindikation
'Vollnarkose' abgeschlossen und das primäre Studienziel erfolgreich
erreicht wurde.
Diese Studie wurde in Japan als eine multizentrische, randomisierte
Parallelgruppenstudie in Chirurgie-Patienten unter Vollnarkose in
Kombination mit Schmerzmitteln durchgeführt. Propofol diente als
Kontrollsubstanz. Remimazolam oder Propofol wurde 375 Patienten intravenös
verabreicht. Die zwei Remimazolam Gruppen mit jeweils 150 Patienten pro
Gruppe erhielten Einleitungsdosen von 6 mg/kg/h oder 12 mg/kg/h und 1
mg/h/kg wurde für die Aufrechterhaltung der Vollnarkose verabreicht. 75
Patienten erhielten eine Standard-Dosierung Propofol. Ziel war es die
Erfolgsquoten der Einleitung und Aufrechterhaltung der Vollnarkose zu
vergleichen.
Bei allen 375 Patienten wurde die Narkose erfolgreich eingeleitet und sie
konnten intubiert werden. Der primäre Endpunkt (Wirksamkeit) für eine
Vollnarkose wurde von 100% der Patienten in allen Gruppen erreicht.
Wirksamkeit war wie folgt definiert: kein Aufwachen während der Operation,
keine Erinnerung an den Eingriff, keine Körperbewegungen beobachtbar und
keine Notwendigkeit für die Gabe eines zusätzlichen Narkosemittels. Somit
wurde das Studienziel erreicht. Wie bei einer Anästhesie Studie üblich,
wurde auf gleiche Wirksamkeit im Vergleich zum derzeitigen
Therapiestandard, in diesem Fall Propofol, getestet.
Es wurden keine besorgniserregenden Nebenwirkungen beobachtet. Die
Inzidenzrate der unerwünschten Ereignisse lag bei 84,7% und 80,7% in den
Dosierungen von 6 mg/kg/h und 12 mg/kg/h mit Remimazolam und 84,0% bei der
Propofol-Gruppe. Zu den häufigen Nebenwirkungen zählten Blutdruckabfall,
primäre Wundkomplikationen, abnormale Laborwerte, Übelkeit/Erbrechen und
Schmerzen an der Injektionsstelle (wurden nur bei der Propofol-Gruppe
beobachtet) usw. und waren somit die allgemein üblichen, zu erwartenden
Nebenwirkungen in der peri-operativen Phase. Die Inzidenzrate für
Blutdruckabfälle lag bei 35,3% und 34,7% in der 6 mg/kg/h und 12 mg/kg/h
Remimazolamgruppe und 60,0% bei der Propofolgruppe. Dies lässt darauf
schließen, dass Remimazolam die Herzfunktion verglichen mit Propofol
deutlich weniger klinisch relevant beeinflusst. Die Inzidenzrate von
Blutdruckabfällen war in beiden Remimazolam Gruppen signifikant niedriger
gegenüber der Propofol-Gruppe (p=0.0004 und p=0.0003 für die 6 und 12
mg/kg/h Dosierungen vs. propofol).
Derzeit laufen noch die pharmakokinetischen und pharmakodynamischen
Modellierungen.
eiersuchen, rätselraten od doch glaskugel?
http://www.acorda.com/
Neuregulin Growth Factor For Treatment of Nervous and Cardiac Systems
Neuregulins are a class of naturally occurring protein growth factors that potentially have multiple effects on the nervous and cardiovascular systems. Acorda is developing its lead recombinant neuregulin candidate, Glial Growth Factor 2 (GGF2), in a number of nervous system and cardiac indications, including heart failure, stroke and peripheral nerve injury. The most advanced of these is a clinical-stage program in heart failure.
Acorda completed a Phase 1 clinical trial of GGF2 in heart failure patients in late 2012. Data from this trial, designed to study safety, tolerability and exploratory measures of efficacy in a single ascending dose of GGF2 in people with heart failure who were already on optimized regimens of currently available cardiovascular therapies, were presented at the American College of Cardiology 62nd Annual Scientific Session in March 2013.
Acorda has discussed the results from the initial GGF2 study with the U.S. Food and Drug Administration (FDA) and has reached agreement on the design of the next clinical study of GGF2 in heart failure, which is expected to begin in 2013.
Heart Failure
Heart failure is a chronic, progressive condition in which the heart muscle is unable to pump enough blood to meet the body's need for oxygen. Heart failure is most commonly the result of damage to the heart, caused by coronary artery disease or from added stress to the heart from other health conditions, such as diabetes or high blood pressure.
GGF2 may offer a unique heart failure therapeutic option, as existing medications aim to compensate for the heart's diminished blood pumping ability, but do not directly restore heart muscle function. GGF2 acts at the level of the muscle cells, or cardiomyocytes, and is believed to improve the heart's ability to contract by restoring cardiomyocyte functions that are impaired in heart failure. Preclinical studies have found that GGF2 improves contractile function and may also protect the heart structure from acute and chronic stressors.
Stroke/Peripheral Nerve Damage
Neuregulins have also demonstrated a range of effects in neuroprotection and repair in preclinical models of disease and injury to both the central and peripheral nervous systems.
In preclinical studies, GGF2 has been shown to partially protect the brain from the consequences of stroke and enhance recovery of sensorimotor function with a wide treatment time window of several days. Preclinical studies have also shown improvements in function following damage to peripheral nerves. In a preclinical model that simulates nerve damage that occurs with surgical prostatectomy, GGF2 was shown to protect nerves and restore erectile function.
Quelle: http://www.paion.de/cns-7056
Remimazolam – Anästhetikum und Sedativum
Remimazolam ist ein innovatives, kurz wirksames Anästhetikum/Sedativum und wird von PAION zunächst für den Einsatz bei kleineren medizinischen Eingriffen entwickelt. Solche Substanzen werden unter anderem bei endoskopischen Untersuchungen, wie beispielsweise Darmspiegelungen, eingesetzt. Bei über 300 Probanden und Patienten zeigte Remimazolam in durchgeführten klinischen Studien nach intravenöser Gabe deutlich einen kontrollierbaren sedierenden Effekt mit einer schnell einsetzenden und wieder abklingenden Wirkung. Dies bedeutet, dass der Patient gezielt für die Dauer des Eingriffs sediert werden kann und anschließend schnell wieder das volle Bewusstsein erlangt. Die schnelle Aufhebung der Wirkung ist darauf zurückzuführen, dass der Wirkstoff von Gewebe-Esterasen abgebaut wird, einer im menschlichen Körper weit verbreiteten Art von Enzymen.
Remimazolam hat zusätzliches Potenzial in der Indikation Anästhesie, welche zunächst von PAIONs Partner Ono Pharmaceutical Co., Ltd. (Ono) für den japanischen Markt entwickelt wird. Weiterhin könnte Remimazolam auch als Anästhetikum während der künstlichen Beatmung auf Intensivstationen eingesetzt werden.
Die bislang durchgeführten Studien mit Remimazolam umfassen vier Phase-I-Studien sowie drei Phase-II-Studien mit Ein- oder Mehrfachgabe ohne Intervention, bei Magen- oder Darmspiegelung oder in der Anästhesie.
Die erhobenen Daten weisen auf eine gute Verträglichkeit von Remimazolam hin. Ein rasches An- und Abfluten der sedierenden Wirkung von Remimazolam wurde bei den Eingriffen beobachtet. Es wurde weiterhin gezeigt, dass es mit Einfach- und Mehrfachdosierungen möglich ist, gleiche (Sicherheit) oder sogar bessere (Wirksamkeit) Ergebnisse im Vergleich zu einer Einfach- oder Mehrfachdosierung des Goldstandards Midazolam zu erzielen. Die Wirkung kann bei Bedarf durch ein bekanntes Gegenmittel (Flumazenil) aufgehoben werden.
Mit den Ergebnissen der Phase-IIb-Studie können die Dosierungsschemata für Phase‑III-Studien festgelegt werden.
Die Substanz ist seit der Akquisition der CeNeS im Portfolio der PAION und wurde ursprünglich von GlaxoSmithKline erworben. In 2007 erhielt Ono im Rahmen einer Lizenzvereinbarung die Entwicklungs- und Vermarktungsrechte von Remimazolam für den japanischen Markt. Yichang Humanwell ist Lizenzpartner in China, Hana Pharm in Südkorea und R-Pharm in Russland (GUS). Bei diesen Kooperationen erfolgt ein permanenter Datenaustausch, so dass jede Partei von den Entwicklungsfortschritten des jeweils anderen Partners profitiert.
Der Partner Ono Pharmaceutical entwickelt Remimazolam derzeit in der Indikation „Anästhesie“ als Leitindikation für den japanischen Markt. Eine Phase-II/III-Studie wurde durch Ono im November 2012 gestartet. Die Rekrutierung der Studie konnte bereits im Mai 2013, und damit deutlich früher als ursprünglich geplant, abgeschlossen werden. PAION erwartet die wichtigsten Eckdaten Anfang 2014. Die Rekrutierung der zweiten Studie des Phase-III-Programms (American Society of Anesthesiologists Klassifizierung III und höher) in schwerkranken Patienten und eine Studie bei Patienten mit chronischen Leberfunktionsstörungen sind ebenfalls abgeschlossen worden. Es wurden keine signifikanten unerwarteten Nebenwirkungen gemeldet. Das japanische Entwicklungsprogramm für die Indikation „Einleitung und Aufrechterhaltung einer Vollnarkose“ ist damit abgeschlossen und die Einreichung des Zulassungsantrags wird in 2014 erwartet. Des Weiteren hat Ono im November 2012 eine Phase-II-Studie in der Indikation „Sedierung auf der Intensivstation“ initiiert. Aufgrund von unklaren pharmakokinetischen Daten bei der langfristigen Anwendung in der Studie hat ONO im August 2013 entschieden, die Studie auszusetzen. Insgesamt wurden alle Patienten erfolgreich sediert, und es wurden keine signifikanten, unerwarteten Nebenwirkungen beobachtet. Derzeit laufen eine Reihe von präklinischen Experimenten und pharmakokinetische Modellierungen auf Basis der Plasma-Proben. Die Ergebnisse werden die Basis für eine eventuell notwendige Dosisanpassung für neue Studien sein. Im Februar 2013 führte PAION ein formelles wissenschaftliches Beratungsgespräch mit der deutschen Zulassungsbehörde zum europäischen Entwicklungsprogramm von Remimazolam in der Indikation „Anästhesie“. Nach erfolgter Genehmigung durch die deutsche Zulassungsbehörde BfArM wurde die europäische Phase-II-Studie mit Remimazolam in der Indikation „Anästhesie“ bei herzchirurgischen Eingriffen im September 2013 gestartet. Insgesamt sollen 90 Patienten behandelt werden. Ergebnisse der Studie werden im ersten Halbjahr 2014 erwartet. Derzeit geht PAION, abhängig vom Abschluss der geplanten und laufenden Studien, davon aus, dass eine Phase-II- und eine Phase-III-Studie in der Indikation „Anästhesie“, neben dem japanischen Entwicklungsprogramm, für eine EU-Zulassung ausreichen werden. In Vorbereitung auf die europäische Phase-III-Studie sind weitere Beratungsgespräche mit den europäischen Zulassungsbehörden geplant.
Bicypapa, vielen Dank für deine Top Infos !!
All das was geschrieben wurde hört sich sehr Zukunftsträchtig an !
Was sollte bei dieser Aktie denn noch schief gehen ?
Sie wird irgendwann die Zulassung bekommen und es werden weite Vertriebswege,
in der großen weiten Welt, vertraglich geregelt.
Aber nach all diesen positiven Punkten, gibt es nicht auch negative Punkte ?
An der Börse kann immer was passieren. Aber unabhängig von allen Szenarien ist und bleibt Paion beim jetzigen Kurs immens unterbewertet.
Nach den vorliegenden Daten glaube ich an einen Erfolg. Das hieße für mich, dass man einen weitaus besseren Wirkstoff im Wirkungs und Nebenwirkungsprofil wie Midazolam oder Propofol nicht zulassen würde. Noch ist Remimazolam nicht zugelassen. Es besteht also immer noch ein wenn auch geringes Restrisiko.
ein Wettbewerber mit einem ähnlichen Produkt das auch kurz vor der Zulassung ist ??
Wie lange benötigt ein neues Medikament bis zur Zulassung wenn alles glatt läuft ?
Hier noch die Liste, die sich zur Zeit in der Entwicklung befindet.
Sedation of the Future: Ideas on the horizon for sedation providers
1. Target controlled infusions. These are programmable computer pumps that deliver sedation meds. Starts with bolus to reach desired blood level based on weight calculation, then switches to an infusion taking into account elimination and metabolism. “Pumps like this are available in most places in the world, multiple drugs can be delivered on a number of pumps titrating each drug and controlled by one computer.” Not FDA Approved in US and Togo.
New Drugs
‘Aquavan’, propofol analog that doesn’t cause ICU syndrome from accumulation of main molecular analog; peak effect about 10 min after dose, but causes genital and anal burning and itching.
Therananc, THRX-91866Novel GABA-ergic drug; extremely rapid, onset and emergence - even faster than propofol. Drug does not redistribute to fat and accumulate in the same way that propofol or lipid soluble opioids do. Astra Zeneca has it.
CNS 7056, Benzodiazapine ester metabolized by plasma esterases, after infusion it reverses in 3-4 minutes instead of 1 hour with midazolam.
JM-1232, non-Benzodiazapine agonist of GABA (so flumazenil reverses it, but it’s not technically a benzo); very little respiratory depression in mice, but takes a long time to wear off; developed by Maruishi in Japan.
Melatonin, apparently can give hypnotic effects.
Biofeedback monitors
Moderation
Zeitpunkt: 18.11.13 16:17
Aktion: Löschung des Beitrages
Kommentar: Urheberrecht: Text ohne Einverständnis des Urhebers veröffentlicht - Löschantrag liegt vor.
Zeitpunkt: 18.11.13 16:17
Aktion: Löschung des Beitrages
Kommentar: Urheberrecht: Text ohne Einverständnis des Urhebers veröffentlicht - Löschantrag liegt vor.
http://www.4investors.de/php_fe/index.php?sektion=stock&ID=75664
PAION: "Eine Neubewertung ist mehr als gerechtfertigt"
18.11.2013 (www.4investors.de) - Die PAION-Aktie gehört derzeit zu den Achterbahnaktien am Markt, die auf viel Aufmerksamkeit stoßen. Gute Nachrichten zu Partnerschaften und den Entwicklungsprogrammen haben den Aktionären der Gesellschaft in den vergangenen Wochen sehr große Gewinne beschert. Das hat einige Spekulationen entstehen lassen. Im Interview mit www.4investors.de steht PAION-Chef Wolfgang Söhngen Rede uns Antwort zu den aktuellen Kursentwicklungen, Gerüchten um Börsenbriefe und den Fortschritten rund um das potenzielle Blockbuster-Narkosemittel Remimazolam.
Es gibt da noch eine Antwort. Vielleicht spekulieren ja jetzt wirklich einige auf eine baldige Übernahme. Ein Wirkstoff, der langfristig Umsätze von über 1 Milliarde $ verspricht, dessen Firma ist wirklich ein lohnendes Objekt und dazu gerade mal mit 55 Millionen € bewertet wird. Und da wird wirklich allen Ernstes gefragt, womit die wirklich noch unterirdisch geringe Bewertung begründet wird.
Soweit ich das jetzt aber von Herrn Söhngen verstanden hab wollte er erst mal das Potenzial von Remimazolam heben, also auslizensieren und fertig entwickeln. Eine spätere Übernahme scheint aber er auch nicht abgeneigt zu sein. Deswegen ist auch eine viel höhere Bewertung angesichts der glänzenden Perspektiven alleine durch Remimazolam denkbar. Als weitere Blockbuster, wenn auch noch in der frühen Entwicklung gibts ja auch noch GGF2.
Deswegen ist Paion selbst nach ca 220 % Kursgewinn immer noch enorm unterbewertet. Mein Vermutung geht dahin, dass wir bald eine Beteiligung an Paion sehen werden. Möglich auch, dass sich Interessenten für eine Übernahme zu erkennen geben. Dafür sind die Daten von ONO einfach zu gut.
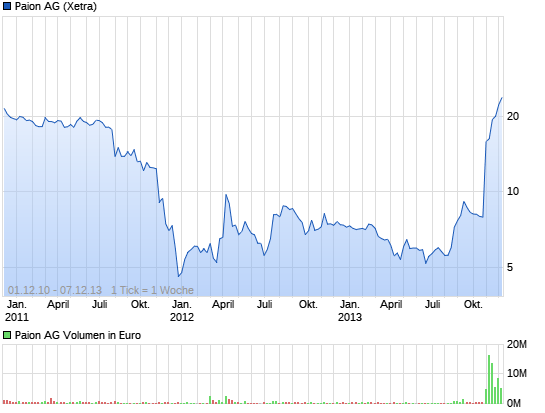
Was für eine Tasse. So ein Chartbild gibts sehr selten. Ein Traum für jeden Charttechniker. Ich glaub die baut noch nicht mal einen Henkel. Einfach Wahnsinn. Der Ausbruch mit einem neuen 3 Jahreshoch ist gestern gelungen.