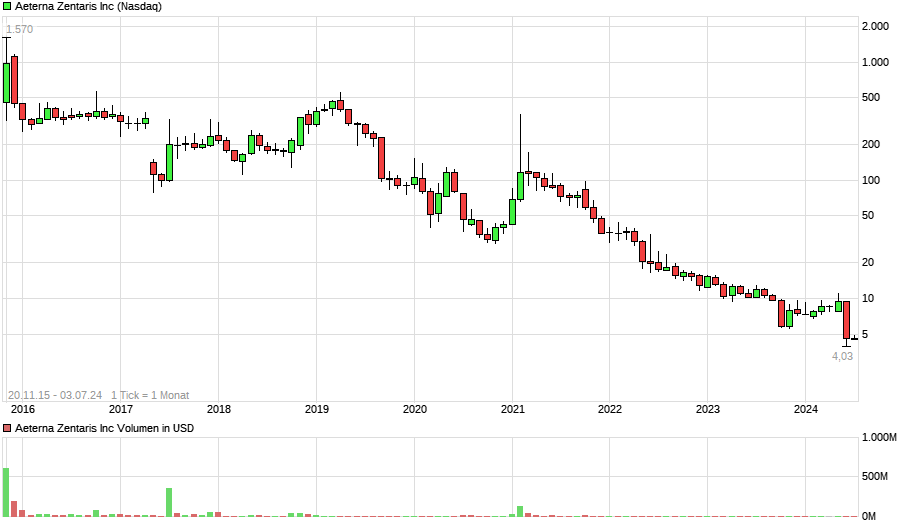
Aeterna nach dem Split
Ist ja nur zu statistischen Zwecken gedacht.
Wer hier unter 50$ schmeißt, sorry, der hat von Biotechs keine Ahnung/Erfahrung.
N.m.p.M.
Ne, zurücklehnen, und genüßlich zuschauen,
wie der Kurs den Wahren Wert sich nähert.
Denn wenn der Zug hier erstmal richtig fahrt aufgenommen hat und zwischendurch immer wieder mal eine erfolgreiche Meldung auf den Bahnhöfen ertönt dann hat sich das mit dem Aussteigen eh erledigt denn wer bitteschön springt aus einem rasenden Zug?
allen investierten ein schönes und endlich mal ein entspanntes(was aeterna betrifft) Wochenende gewünscht.
Sind nämlich Gewinne.
Auch der Hebel hat dann seine Wirkung.
Also muss ich wohl aus dem Ask kaufen!
André Kostolany Zitate
10 Zitate und Sprüche von André Kostolany
§
An der Börse sind 2 mal 2 niemals 4, sondern 5 minus 1. Man muss nur die Nerven haben, das minus 1 auszuhalten.
§
Wenn alle Spieler auf eine angeblich todsichere Sache spekulieren, geht es fast immer schief.
§
EDV-Systeme verarbeiten, womit sie gefüttert werden. Kommt Mist rein, kommt Mist raus.
§
Wer viel Geld hat, kann spekulieren. Wer wenig Geld hat, darf nicht spekulieren. Wer kein Geld hat, muss spekulieren.
§
Einer Straßenbahn und einer Aktie darf man nie nachlaufen. Nur Geduld: Die nächste kommt mit Sicherheit.
Will sagen, generieren Gewinne aus Ihren Gewinnen.
Schon mal was von "Hebelwirkung" gehört/gelesen?
Jede Clofrau hätte es besser geschrieben.
http://www.investopedia.com/news/...ng-deal-sta-aezs/?partner=YahooSA
Durch Shobhit Seth | 13. Oktober 2016 - 12.34 Uhr EDT
Aeterna Zentaris Inc. ( AEZS ) kündigte sie einen exklusiven Lizenzvertrag mit Spezial - Therapeutika Asien (STA) für die potenzielle Vermarktung von Aeterna Führung Prüfpräparate Anti-Krebs - Medikament unterzeichnet, Zoptrex (zoptarelin Doxorubicin) in Australien und Neuseeland.
Krebs beginnt in Womb
Der Schlüssel Medikament befindet sich derzeit in klinischen Phase-III-Studie für seine Verwendung Beurteilung Endometriumkarzinom bei der Behandlung, eine Art von Krebs, die in der Auskleidung der Gebärmutter beginnt (Uterus). Die Versuche werden voraussichtlich bis Ende 2016 abgeschlossen ist , und wenn alles gut geht , das Unternehmen plant für New Drug Application (NDA) an die Datei Food and Drug Administration (FDA) in der ersten Hälfte 2017. (Weitere Informationen finden sich 8 Stadien der Entwicklung neuer Medikamente .)
Der Deal
Gemäß den Bedingungen des Abkommens, STA wird die Lizenz an Aeterna Zentaris das geistige Eigentum zu Zoptrex interessiert sind, und das Recht auf Vermarktung und Kommerzialisierung von Zoptrex in Australien und Neuseeland haben. Aeterna Zentaris wird eine nicht rückzahlbaren Vorauszahlung von STA zu erhalten berechtigt.
Aeterna Zentaris wird auch berechtigt sein, zusätzliche Zahlungen erhalten für das Erreichen vorab vereinbarten regulatorischer und kommerzieller Meilensteine und Lizenzgebühren für alle künftigen Nettoumsatz des Medikaments in diesen Märkten auf ein zweistelliges prozentuales erhalten.
STA wird die Entwicklung, Registrierung, Erstattung und Kommerzialisierung des Medikaments verantwortlich. Aeterna Zentaris hat sich bereit erklärt Zoptrex STA für die Dauer der Lizenzvereinbarung zu liefern.
STA verfügt über ein etabliertes Portfolio von Krebsmedikamenten mit einer Hochburg in Südostasien, Australien und Neuseeland. Bei Bekanntgabe der Deal, ausgedrückt Aeterna Zentaris Beamten Vertrauen in Kapazität Position des STA ihren wichtigsten Medikament in den Märkten. (Weitere Informationen finden sich pharmazeutische Unternehmen auswerten .)
8 Etappen von New Drug Development Von Tim Parker
http://www.investopedia.com/articles/investing/...rug-development.asp
Wenn Sie eine Achterbahnfahrt voller Höhen, Tiefen wollen, Drehungen und Wendungen, bewegen einen Teil Ihres Portfolios für die Pharma- oder Biotech-Branche. Jeden Tag, auch am Wochenende, Nachrichten Leitungen sind voll von Pressemitteilungen von diesen Unternehmen die Ergebnisse der klinischen Studien skizziert durchgeführt auf neue und experimentelle Drogen und Verbindungen.
Diese Veröffentlichungen werden oft mit Informationen gefüllt, dass die durchschnittliche Person nicht versteht. Zum Beispiel am 11. Juli Celgene (NASDAQ: CELG ) gab heute seine Ergebnisse aus einer Phase - 3 - Studie seines Medikaments Revlimid, dass die Aktie steigenden 7 Prozent gesendet. Ebenfalls am 11. Juli Bristol-Myers Squibb (NYSE: BMY ) und Pfizer (NYSE: PFE ) bekannt , dass die FDA für die Überprüfung eine ergänzende Zulassungsantrag für Eliquis, vorbeugende Medikament gegen Lungenembolie akzeptiert.
SEE: Die Höhen und Tiefen des Biotechnologie
Was ist eine klinische Studie, was sind die verschiedenen Phasen, und warum in den Kurs der Aktie im zweistelligen bewegt die Ergebnisse dieser Studien und Anwendungen oft schaffen?
Was ist eine klinische Studie?
Auch als eine interventionelle Studie, eine klinische Studie beinhaltet die Teilnehmer bestimmte medikamentöse Therapien, medizinische Geräte geben, oder Verhaltensänderungen seine Wirksamkeit zu untersuchen. Diese Studien vergleichen oft eine neue medizinische Therapie zu einer bereits bestehenden. Wenn es eine Droge ist, ist die experimentelle Verbindung zu einigen Patienten gegeben, während ein Placebo, eine inaktive Verbindung ohne medizinische Wirkung, an andere weitergegeben wird.
Klinische Studien werden oft von einem Arzt betreut, die einen Support-Mitarbeiter von anderen Ärzten und medizinischen Fachleuten hat. Sie sind oft von einem pharmazeutischen Unternehmen, Universität, private Stiftung oder anderen öffentlichen und privaten Organisationen gefördert.
Was sind klinische Studien Phasen?
Die meisten Biotech- und Pharma Geschichten, die Sie etwas über Phase erwähnen lesen 1, Phase 2 und Phase 3 Studien, aber was bedeutet das?
Im Falle von Arzneimitteln ist die Food and Drug Administration verantwortlich für alle Medikamente für den öffentlichen Verkauf genehmigen. Die Agentur setzt voraus, dass alle Medikamente den gleichen Weg zu folgen Genehmigung.
Investigational New Drug Application (IND)
Das Sponsoring Pharmaunternehmen legt diese an die FDA, oft nach dem Rat der Agentur suchen. Die Anwendung erfordert, dass das Unternehmen zeigen die Ergebnisse von Tests an Versuchstieren durchgeführt und wie sie die Studie am Menschen durchzuführen planen. Die FDA, zusammen mit einer Gruppe von Experten genannt Institutional Review Board (IRB), dann entscheidet, ob es sicher ist, in die klinische Testphase fortzusetzen.
SEE: Arzneimittelindustrie: Hat die FDA - Hilfe oder Schaden?
Klinische Studienprotokolle
Der IRB sucht die Details der Versuchsprotokolle. Dazu gehören die Art der Teilnehmer, Zeitplan des Testens, der Medikation und Dosierung, der Dauer der Studie, und ihre Ziele. Sobald die Protokolle zugelassen sind, beginnen die Prüfungen.
Phase 1
Phase-1-Studien Test für die Sicherheit. Das Medikament wird bei gesunden Probanden gegeben das Medikament die häufigsten Nebenwirkungen zu ermitteln und wie es absorbiert und ausgeschieden. Normalerweise werden 20 bis 80 Personen in der Phase-1-Studien teilzunehmen.
Phase 2
Funktioniert das Medikament? das Medikament Bereitstellung wird für eine weitere Studie bestätigt, Phase 2 wird zusammen mit weiteren Sicherheitsüberwachung für die Wirksamkeit zu testen. Hat das Medikament eine klinisch signifikante Ergebnisse für die Bedingung es gemeint zu behandeln? Beteiligt sind die mit der Krankheit oder Erkrankung, die das Medikament indiziert ist. Dies ist, wo einige Teilnehmer das aktive Arzneimittel erhalten, während andere ein Placebo oder ein anderes Medikament erhalten. Teilnehmer reichen von einigen Dutzend bis zu mehr als 300.
SEE: Auswertung Pharma - Unternehmen
Phase 3
Ist es besser als die derzeitigen Behandlungen? Die FDA und des Sponsors Arbeit Droge zusammen die Phase-3-Studien zu entwerfen. Sie könnten das Medikament auf verschiedenen Populationen in verschiedenen Dosierungen untersuchen, und in Kombination mit anderen Arzneimitteln. Diese sind oft doppelblinden Studien, bei denen weder die Teilnehmer noch die Forscher wissen, wer den Wirkstoff erhalten haben. Phase 3-Studien sind groß im Umfang, manchmal Zehntausende von Menschen auf der ganzen Welt beteiligt ist, aber nach der FDA, die meisten sind nicht größer als 3000. Wenn das Medikament gefunden wird, den Patienten mehr als andere Drogen zu profitieren, und die Nebenwirkungen sind überschaubar, ein neues Medikament Anwendung eingereicht wird.
New Drug Application
Die FDA hat 60 Tage, um zu entscheiden, ob der Antrag zur Überprüfung eingereicht werden. Wenn der Antrag unvollständig ist, wird die Anwendung auf das Medikament Sponsor zurückgeschickt. Es könnte etwas so einfaches wie fehlende Unterlagen oder so teuer sein wie die nicht Teil der klinischen Studie Prozesses.
Mögliche Zulassung
Die FDA wird die Produktionsstätte besuchen, Kennzeichnungsinformationen und studieren alle Informationen über klinische Studien überprüfen, um eine Entscheidung zu treffen, ob die Droge zu genehmigen.
Phase 4
Phase 4 Studien sind manchmal zu studieren Effekte durchgeführt, die entstehen, wenn das Medikament zugelassen ist und gewinnt weit verbreitet. Wenn eine Nebenwirkung in einer signifikanten Anzahl von Patienten berichtet, könnte eine Phase 4 Studie suchen, um zu bestimmen, ob die Nebenwirkung auf das Medikament angeschlossen ist, oder von dem Medikament in Kombination mit einem anderen oder bestimmten Lebensmitteln.
Für eine Infografik, die den Prozess beschreibt, hier klicken .
Warum sind Biotech und Pharma - Aktien so Flüchtige?
Je größer das Unternehmen, desto weniger ungünstigen klinischen Daten wird der Aktienkurs beeinflussen, aber für den kleinen Start-ups, die nur eine Art der Therapie kann die Entwicklung, wenn es an einer beliebigen Stelle im klinischen Prozess fehlschlägt, kann die Rentabilität des Unternehmens geht nach vorn sein fraglich.
Nach Angaben der Pharma-Forschung und Hersteller von Amerika (PhRMA), könnte die Entwicklung eines einzigen Medikament kostet weniger als $ 1,3 Mrd. 2005 Dollar. Zwar gibt es eine breite Palette von Preisschildern auf die Arzneimittelentwicklung ist, was klar ist, dass es teuer ist. An jedem Punkt in dem Prozess, könnte das Medikament Bedeutung aufgegeben werden, dass alle oder die meisten das Geld in sie investiert ist weg.
Nach Angaben der FDA, werden die meisten Medikamente in der Entwicklung am Ende nicht auf Apotheke Regalen, den Prozess für die Pharmaindustrie eine hohe Dollar-Glücksspiel zu machen.
SEE: Pharmaceutical Phenoms: Amerikas Bestseller-Medikamente
Take Action
Nächstes Mal, wenn Sie eine Pressemitteilung lesen, darüber nachzudenken, wie weit ein Medikament oder ein Gerät in seiner Entwicklung. Am 11. Juli Alnylam Pharmaceuticals (NASDAQ: ALNY ) berichtete positive Phase - 1 - Daten auf einer Verbindung es ALN-TTRsc nennt. Während dieser zweistellige Gewinne für die Aktie erstellt, nicht schnell sein Geld in Namen zu gießen, die frühzeitig Ergebnisse berichten.
Wenn Phase 2 oder Phase-3-Studien die angestrebten Ergebnisse nicht produzieren, alle Gewinne, plus eine Menge mehr kann an einem Tag gelöscht werden. Im Allgemeinen, wenn Sie eine längerfristige Perspektive haben, suchen Unternehmen, die später Ergebnisse bekannt geben. Diese Bestände sind eher längerfristigen Durchhaltevermögen zu haben.