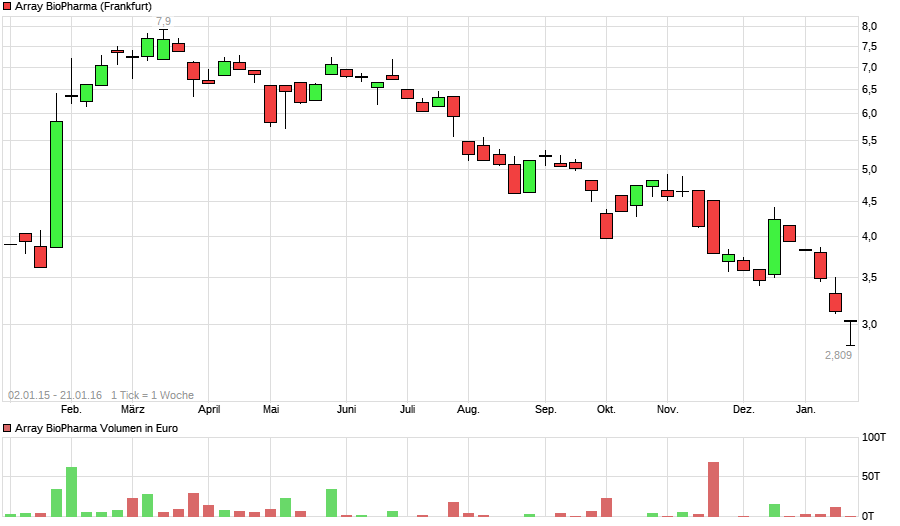
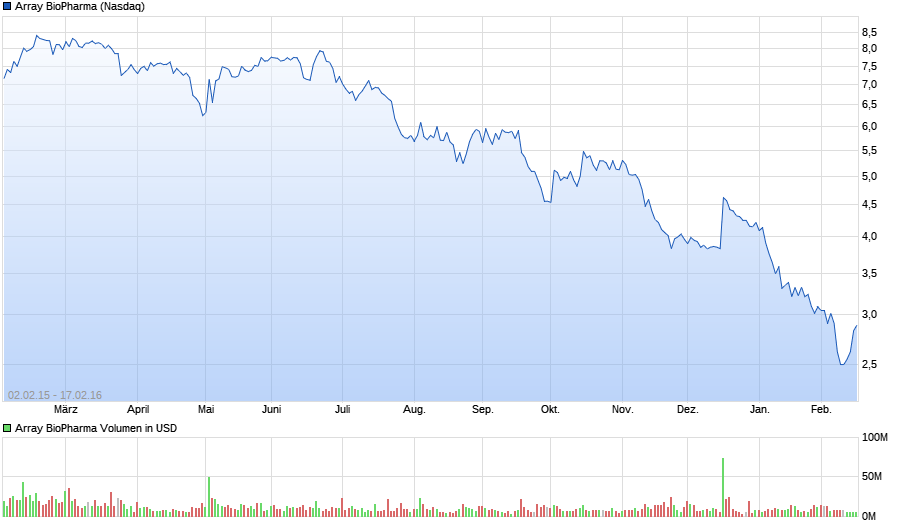
top oder flop
Seite 1 von 3 Neuester Beitrag: 01.03.16 22:08 | ||||
| Eröffnet am: | 04.07.03 15:17 | von: preisfuchs | Anzahl Beiträge: | 56 |
| Neuester Beitrag: | 01.03.16 22:08 | von: Heron | Leser gesamt: | 23.116 |
| Forum: | Börse | Leser heute: | 3 | |
| Bewertet mit: | ||||
| Seite: < 1 | 2 | 3 > | ||||
13.05 02.02.16
http://www.ariva.de/news/...The-Second-Quarter-Of-Fiscal-2016-5634337
BOULDER, Colo., 2. Februar 2016
BOULDER, Colo., Februar 2, 2016 / PRNewswire / - Array BioPharma Inc. (NASDAQ: ARRY) hat heute die Ergebnisse für das zweite Quartal 31. Dezember 2015 des Geschäftsjahres endet und ein Update über den Stand der wichtigsten klinischen Entwicklungsprogrammen.
Array BioPharma. (PRNewsFoto/Array BioPharma Inc.)
Ron Squarer, CEO von Array, bemerkte: "Wir waren in diesem Quartal aufgeregt positiven Ergebnisse der ersten weltweiten Phase-3-Studie von binimetinib bei Patienten in NRB-mutierten Melanomen zu teilen. Wir haben vor, während 2016 diese Ergebnisse den Aufsichtsbehörden einzureichen In Außerdem setzen wir wichtige Fortschritte mit binimetinib und encorafenib in mehreren anderen klinischen Studien zu machen, und erwarten, dass Top-Line-Ergebnisse aus Columbus in 2016 BRAF-mutierten Melanomen bekannt zu geben "
KEY PIPELINE UPDATES
Binimetinib (MEK162) und encorafenib (LGX818)
NEMO erreicht primären Endpunkt; Zulassungsantrag in 1H 2016 erwartet
COLUMBUS Top-Line-Ergebnisse im 1. Halbjahr erwartet 2016; Zulassungsantrag in 2H 2016 erwartet
Neue Phase-3-Zulassungsstudie weltweit in BRAF-mutierten erwartet Darmkrebs im Jahr 2016 zu starten
Update auf Phase 3-Studien
Im Dezember 2015 Array gemeldet Top-Line-Ergebnisse aus der laufenden Phase-3-NEMO-Studie mit binimetinib bei Patienten mit fortgeschrittenem NRB-mutierten Melanomen. Die Studie erreichte ihren primären Endpunkt einer Verbesserung des progressionsfreien Überlebens (PFS) im Vergleich mit Dacarbazin Behandlung mit einem Hazard-Ratio von 0,62 [95% CI 0,47-0,80] und einem p-Wert von weniger als 0,001. Die mediane PFS auf dem binimetinib Arm 2,8 Monate versus 1,5 Monate auf der Dacarbazin Arm. In der Studie war binimetinib im Allgemeinen gut vertragen und die Neben berichteten Ereignisse waren mit früheren Ergebnissen in NRB Melanom-Patienten überein.
Array plant binimetinib an die Regulierungsbehörden die Marktzulassung in NRB-mutierten Melanomen in der ersten Hälfte von 2016. Die Ergebnisse des NEMO Studie mit progressionsfreies Überleben, Gesamtüberleben, die objektive Ansprechrate, Sicherheit und vorgegebenen Untergruppenanalysen, einschließlich Ergebnisse bei Patienten zu unterwerfen, die erhielten vor der Behandlung mit Immuntherapie im Jahr 2016 bei einer medizinischen Konferenz präsentiert werden.
Darüber hinaus Array Top-Line-Ergebnisse aus Teil 1 der COLUMBUS-Studie in der ersten Jahreshälfte 2016 erwartet und zeigt ein Zulassungsantrag von binimetinib und encorafenib im Jahr 2016. Im Oktober 2015 Teil 2 von COLUMBUS erreicht sein Ziel Patientenaufnahme. Der MILO Phase-3-Studie bei Patienten mit low-grade serösen Ovarialkarzinom weiterhin Patienten einschreiben und Array schätzt Einschreibung mit der Verfügbarkeit von Top-Line-Daten im Jahr 2016 abgeschlossen sein, zusammen mit einer geplanten Zulassungsantrag, im Jahr 2017.
Basierend auf der Stärke der Kombination Phase-2-Daten mit encorafenib bei Patienten mit BRAF-Mutante in der 2015 European Society geteilt Darmkrebs für Medizinische Onkologie (ESMO) Weltkongress der Magen-Darm-Krebs, Array plant, eine Phase-3-global-Zulassungsstudie, dass zu initiieren Patientenpopulation im Jahr 2016.
Die Zusammenarbeit mit Pierre Fabre
Im November 2015 Array und kündigte Pierre Fabre eine Kooperationsvereinbarung für binimetinib und encorafenib. Gemäß den Bedingungen der Vereinbarung erhielt Array eine Vorauszahlung in Höhe von 30.000.000 $ im Januar 2016 und behält die exklusiven Vermarktungsrechte für binimetinib und encorafenib in wichtigen Schlüsselmärkten, darunter die Vereinigten Staaten und Japan. Pierre Fabre Exklusivrechte haben beide Produkte in anderen zu kommerzialisieren Gebiete, auch in Europa, Asien und Lateinamerika. Array ist berechtigt, zu 425.000.000 $ erhalten, wenn bestimmte Entwicklung und Vermarktung Meilensteine erreicht werden, und ist geeignet für robuste, abgestufte Lizenzgebühren in zweistelliger. Array und Pierre Fabre haben vereinbart, künftig Entwicklungskosten auf einer 60:40 Basis (Array: Pierre Fabre) zu spalten mit einer Anschubfinanzierung für neue klinische Studien in der Darmkrebs und Melanome verpflichtet. Die Vereinbarung wurde von der Europäischen Kommission über die Wettbewerbs im Dezember 2015. Alle derzeit aktiven binimetinib und encorafenib klinischen Studien bleiben bis zum Abschluss von Novartis im Wesentlichen finanziert, geprüft und genehmigt.
Pierre Fabre Onkologie, ein Geschäftsbereich des globalen 10.000 Mitarbeiter Pierre Fabre Unternehmen, wird von mehr als 1.000 Mitarbeiter mit einem starken Fokus auf den europäischen Märkten unterstützt. Im Jahr 2014 übertroffen weltweit einen Jahresumsatz von Pierre Fabre Onkologie Produkte 200.000.000 $ von der Stärke der Mund Navelbine, Javlor und Busilvex Marken. Darüber hinaus hat Pierre Fabre ein starkes Engagement und Track Record in der pharmazeutischen Forschung und Entwicklung, die Entwicklung von Produkten für Patienten mit Lungen behaftet, Brustkrebs und anderen soliden Tumoren und hämatologischen Krebserkrankungen.
ARRY-797 (ARRY-371797) - Phase 2-Studie im Gange bei Patienten mit LMNA A / C-bezogenen dilatative Kardiomyopathie (DCM)
Array ist die Durchführung einer 12-Patienten Phase-2-Studie zur Untersuchung der Wirksamkeit und Sicherheit von ARRY-797 bei Patienten mit LMNA A / C-bezogenen DCM, eine schwere, genetisch kardiovaskulären Erkrankungen zu bewerten. Im Alter von 45, ca. 70% der Patienten mit LMNA A / C-bezogenen DCM gestorben, erlitt eine schwere Herzereignis, oder wird eine Herztransplantation unterzogen. Die Daten über den primären Endpunkt der mittleren Veränderung der 6-Minuten-Gehtest (6MWT) nach 12 Wochen Vergleich zum Ausgangswert überschreitet durch eine Reihe von Medikamenten für seltene Krankheiten festgelegten Benchmarks vor kurzem genehmigt auf der Grundlage des 6MWT als primären Endpunkt. Die sekundären Endpunkte, einschließlich Änderungen der N-terminalen Pro-brain-derived natriuretischen Peptid (NT-proBNP, einem Serum-Biomarker von Herzinsuffizienz Schweregrad), und die Behandlungsergebnisse berichtet, sind richtungs im Einklang mit den primären Endpunkt. Einschreibung in dieser Studie ist abgeschlossen. Daten für Patienten über 48 Wochen gefolgt unterstützt die Haltbarkeit der Wirkung. Zusammengenommen deuten die Daten auf dem Laufenden einen Weg in die Zukunft für dieses Programm. Ergebnisse mit zusätzlichen Patienten Follow-up wird in einer geeigneten medizinischen Konferenz im Jahr 2016 vorgelegt werden.
Selumetinib (in Partnerschaft mit Astrazeneca) - drei Zulassungsstudien in NSCLC fort (SELECT-1), Schilddrüsen-Krebs (ASTRA) und Neurofibromatose Typ 1
Astrazeneca weiterhin selumetinib in drei Zulassungsstudien voranzutreiben: SELECT-1 bei Patienten mit KRAS-mutierten nicht-kleinzelligem Lungenkrebs, eine Zulassungsstudie bei Patienten mit Neurofibromatose Typ 1 und ASTRA in Patienten mit differenziertem Schilddrüsenkrebs. Astrazeneca erwartet Top-Line-Ergebnisse aus SELECT-1 in Mitte 2016 zu teilen.
KENNZAHLEN
Liquide Mittel, Wertpapiere und Forderungen betrugen 185.400.000 $ am Ende des Quartals. Konten in erster Linie Forderungen von Forderungen bestehen erwartet von Novartis innerhalb von drei Monaten gezahlt werden und die Gebühr $ 30,0 Mio. Lizenz von Pierre Fabre, die im Januar 2016 Im März 2015 binimetinib und encorafenib empfangen wurde wurde hundertprozentige Vermögenswerte, die auf die aufgefordert, Änderungen Aufteilung der Umsatzerlöse und Aufwendungen für die Programme. Die neuen Kosten Einstufungen wurden im vierten Quartal des Geschäftsjahres 2015 die Finanzergebnisse und, beginnend im ersten Quartal des Geschäftsjahres 2016 enthalten, Array mit Umsatz von Novartis Erstattungen im Rahmen ihrer Vereinbarungen mit Novartis für binimetinib und encorfenib als separater Posten "Erstattung Einnahmen genannt . "
Zweite Quartal des Geschaftsjahres 2016 im Vergleich zum ersten Quartal des Geschäftsjahres 2016 (Sequential Quarters Vergleich)
Der Umsatz für das zweite Quartal des Geschäftsjahres 2016 war $ 35.400.000 im Vergleich zu $ 16.200.000 für den Stand der Folgequartalen. Der $ 19.200.000 Umsatzsteigerung ist vor allem auf höhere Erstattungs Umsatz von Novartis. Kosten der Partner-Programme für das zweite Quartal des Geschäftsjahres 2016 betrug $ 5,7 Mio. im Vergleich zu $ 6.200.000 für das Vorquartal. Forschungs- und Entwicklungskosten wurde 41.400.000 $ im Vergleich zu $ 21,0 Mio. im Vorquartal. Der Anstieg der Forschungs- und Entwicklungsaufwand wird auf die anhaltende Übergang von binimetinib und encorafenib Studien von Novartis zu Array. Der Nettoverlust für das zweite Quartal in erster Linie im Zusammenhang war $ 24.200.000 oder ($ 0,17) je Aktie und lag bei $ 21,0 Mio. oder ($ 0.15) pro Aktie im Vorquartal.
Zweite Quartal des Geschaftsjahres 2016 im Vergleich zum zweiten Quartal des Geschäftsjahres 2015 (Vorjahr zum Vergleich)
Im Vergleich zum gleichen Quartal des Geschäftsjahres 2015 Umsatzerlöse für das zweite Quartal des Geschäftsjahres 2016 erhöhte Mio. $ 8.500.000 in erster Linie auf $ 27,3 in Erstattung Umsatz von Novartis. Kosten der Partnerprogramme verringert $ 7.400.000 im Vergleich zum zweiten Quartal des Geschäftsjahres 2015 vor allem auf binimetinib Entwicklungskosten werden als Forschungs- und Entwicklungsaufwand statt Kosten für Partnerprogramme vorgestellt hundertprozentige Programme auf zu werden. Forschungs- und Entwicklungskosten $ 29.500.000 erhöhte sich im Vergleich zum zweiten Quartal des Geschäftsjahres 2015 aufgrund der Kategorisierung von binimetinib Kosten sowie neue Ausgaben auf encorafenib. der Nettoverlust für das zweite Quartal des Geschäftsjahres 2016 war $ 24.200.000 oder ($ 0,17) je Aktie, und war im Geschäftsjahr 2015 $ 8,6 Mio. oder ($ 0,06) je Aktie im gleichen Quartal.
Sechs Monaten des Geschäfts 2016 im Vergleich zum Halbjahr des Geschäftsjahres 2015 (Vorjahr zum Vergleich)
Für die sechs Monate zum 31. Dezember 2015 betrug der Umsatz $ 51.600.000 im Vergleich zu $ 33,0 Mio. für den gleichen Zeitraum im Geschäftsjahr 2015. Der Nettoverlust für die sechs Monate zum 31. Dezember 2015 war $ 45.200.000 oder ($ 0,32) je Aktie, im Vergleich zu einem Nettoverlust von $ 36.200.000 oder ($ 0,27) je Aktie im vergleichbaren Vorjahreszeitraum.
Informationen zur Telefonkonferenz
Array wird eine Telefonkonferenz am Dienstag, den 2. Februar 2016 um 9:00 Uhr Eastern Time halten diese Ergebnisse zu erörtern. Ron Squarer, Chief Executive Officer, wird das Gespräch führen.
Um die ursprüngliche Version auf PR Newswire zu sehen, visit: http://www.prnewswire.com/news-releases/...fiscal-2016-300213449.html
SOURCE Array BioPharma Inc.
Quelle: PR Newswire
http://ih.advfn.com/p.php?pid=nmona&article=70589699
BOULDER, Colo, 1. März 2016 / PRNewswire / - Array BioPharma Inc. (Nasdaq: ARRY) gab heute bekannt , dass ihr Chief Executive Officer, Ron Squarer, an der Cowen and Company Annual Healthcare Conference in Boston präsentiert. Die Öffentlichkeit ist herzlich willkommen in der Konferenz über einen Webcast auf der Array BioPharma Website teilzunehmen.
Array BioPharma.
Event:
§
Cowen and Company Annual Healthcare Conference
Moderator:
§
Ron Squarer, Chief Executive Officer
Datum:
§
Montag, 7. März 2016
Zeit:
§
04.40 Eastern Time
Ort:
§
Das Boston Marriott Copley Place, Boston, MA
Webcast:
§
http://wsw.com/webcast/cowen30/arry
Über Array BioPharma
Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Kommerzialisierung von gezielten, niedermolekulare Medikamente Patienten mit Krebs leidet, zu behandeln. Sechs Zulassungsstudien sind avanciert gegenwärtig im Zusammenhang mit drei Krebsmedikamente. Zu diesen Programmen gehören binimetinib, encorafenib und selumetinib (Astrazeneca). Für weitere Informationen über Array, gehen Sie bitte auf www.arraybiopharma.com.
KONTAKT:
§
Tricia Haugeto
§
Array BioPharma Inc.
303-386-1193
§
thaugeto@arraybiopharma.com
§
Logo - http://photos.prnewswire.com/prnh/20121029/LA02195LOGO
Um die ursprüngliche Version auf PR Newswire zu sehen, visit:http://www.prnewswire.com/news-releases/...-conference-300228780.html
SOURCE Array BioPharma
Copyright 2016 PR Newswire