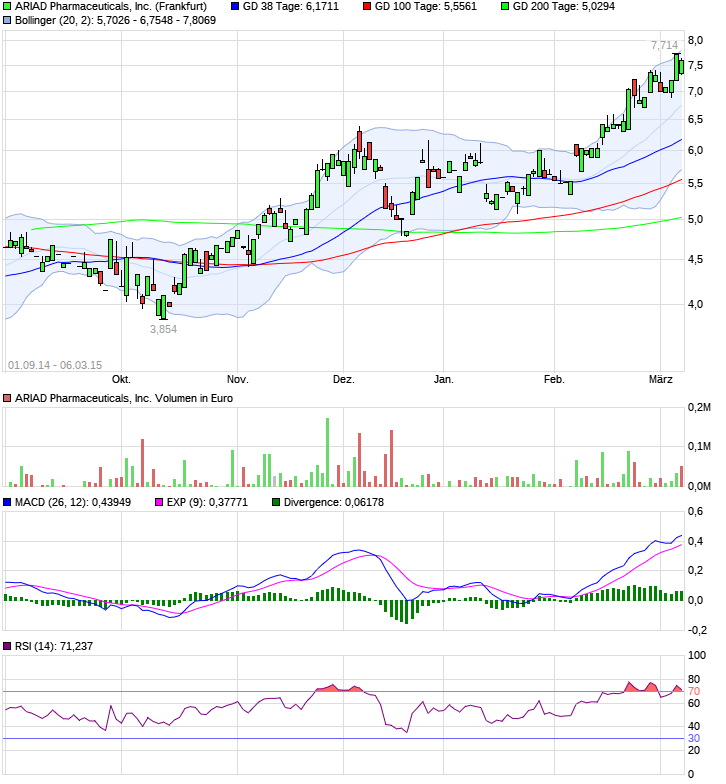
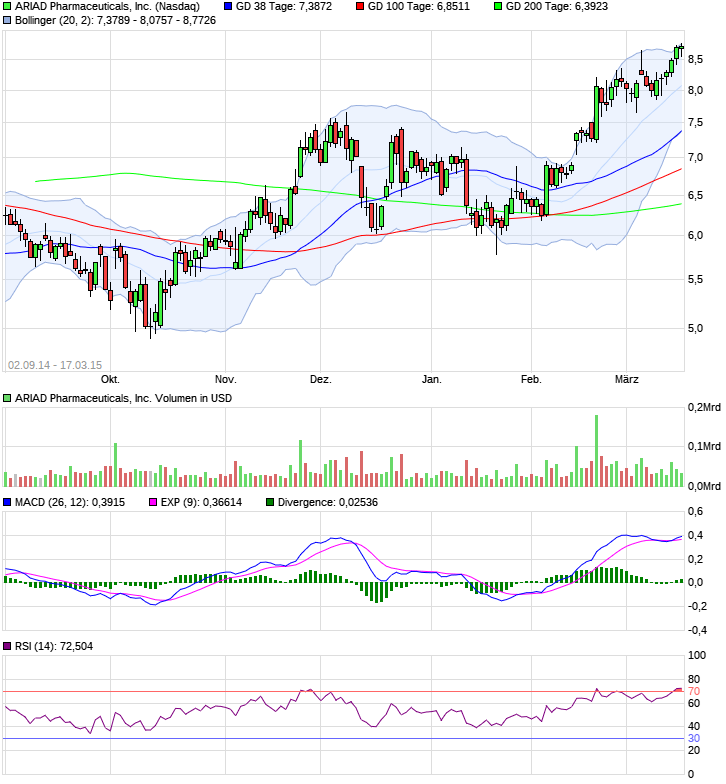
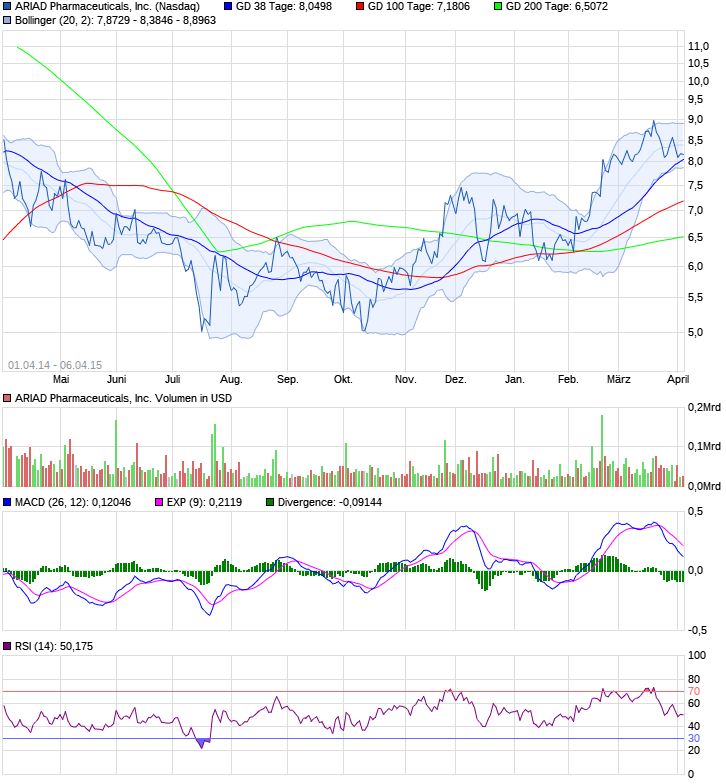
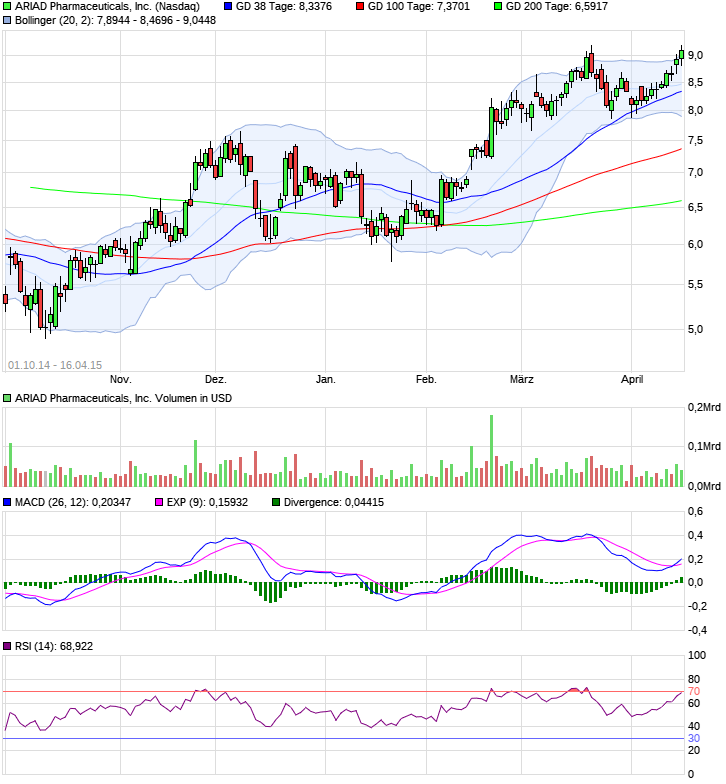
Ariad Pharmaceuticals-Neu
http://investor.ariad.com/...22&p=irol-newsArticle&ID=2024415
ARIAD gibt Abweisung der Aktionärsklage in Federal District Court
CAMBRIDGE, Mass. - (BUSINESS WIRE) - März 10, 2015-- ARIAD Pharmaceuticals, Inc. (NASDAQ: ARIA) gab heute bekannt, dass das US-Bezirksgericht für den Bezirk Massachusetts wies die Aktionärsklage Ende 2013 im Zusammenhang mit den Ereignissen im Vorfeld der vorübergehenden Aussetzung der Vermarktung und Vertrieb von Iclusig eingereicht gegen die Gesellschaft und einige ihrer leitenden Angestellten und Direktoren ® (Ponatinibs) auf 31. Oktober 2013 Und die anschließende Re-Launch in Januar 2014 gestützt auf revidierte US-Verschreibungsinformationen und eine Risikobewertung und Minderungsstrategie.
Die Klage behauptet, Verletzung der Treuepflicht, Veruntreuung von vertraulichen Informationen und Insiderhandel. Das Gericht hat der Gesellschaft den Antrag, die Klage abzuweisen und befand, dass der Kläger versäumt, eine Forderung der Board of Directors des Unternehmens, um die Vorwürfe zu untersuchen machen wie erforderlich Delaware Recht, der Staat, wenn die Gesellschaft integriert, und auch keine ausreichenden Tatsachen behaupten, dass die Nachfrage zu entschuldigen.
"Wir freuen uns, dass das Gericht erteilte dem Antrag auf Klageabweisung, was wir von Anfang an geglaubt, war ein meritless Klage", sagte Harvey J. Berger, MD, Vorsitzender und Chief Executive Officer von ARIAD. "Unsere Unternehmenswerte sind immer an der Spitze, da wir weiterhin auf die Umsetzung unseres Plans für nachhaltiges Wachstum zu konzentrieren und zu erwartenden Rentabilität im Jahr 2018"
Über ARIAD
ARIAD Pharmaceuticals, Inc. Mit Sitz in Cambridge, Massachusetts und Lausanne, Schweiz , Ist ein integriertes, globales Onkologie-Unternehmen auf das Leben von Krebspatienten mit Durchbruchs Medikamente Umwandlung konzentriert. ARIAD wird arbeiten an neuen Arzneimitteln, um die Behandlung verschiedener Formen von chronischen und akuten Leukämie, Lungenkrebs und andere schwer zu behandelnde Krebsarten zu fördern. ARIAD nutzt Rechen und strukturelle Ansätze für niedermolekulare Medikamente, die Resistenz gegen bestehende Krebsmedikamente zu überwinden, zu entwerfen. Für weitere Informationen, besuchen Sie http://www.ariad.com oder folgen Sie ARIAD auf Twitter ( ARIADPharm ).
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen. Alle Aussagen hierin enthaltenen, die nicht Tatsachen der Vergangenheit beschreiben, einschließlich, aber nicht beschränkt auf, Aussagen über: unsere Pläne für nachhaltiges Wachstum und die erwarteten Profitabilität im Jahr 2018; und unsere Bemühungen, neue Krebsbehandlungen verwandt sind, sind zukunftsgerichtete Aussagen, die auf Treu und Glauben die Erwartungen des Managements beruhen und mit Risiken und Unsicherheiten, welche die tatsächlichen Ergebnisse wesentlich von den in solchen vorausschauenden Aussagen abweichen können. Zu diesen Faktoren, Risiken und Unsicherheiten beinhalten, sind aber nicht beschränkt auf, ist die Bewegung, die Aktionärsklage entlassen rechtskräftig und könnte aufgehoben werden beschränkt; unsere Fähigkeit, eine Partnerschaft für brigatinib (AP26113) zu sichern; Schwierigkeiten oder Verzögerungen bei der Erlangung von behördlichen und Preisfindung und Erstattung Zulassungen unserer Produkte und Produktkandidaten zu vermarkten; unsere Fähigkeit, erfolgreich zu vermarkten und die Gewinne aus dem Verkauf von Iclusig oder zukünftigen Produkte zu generieren; Konkurrenz von alternativen Therapien; die Durchführung und die Ergebnisse der präklinischen und klinischen Studien der Produktkandidaten; die Angemessenheit unserer Kapitalausstattung und der Verfügbarkeit zusätzlicher Finanzierung; Patentschutz und Drittanbieter-Forderungen nach geistigem Eigentum; Risiken für wichtige Mitarbeiter, Märkte, Wirtschaftsbedingungen, Gesundheitsreform, die Preise und Erstattungssätze stehen; und andere Risikofaktoren in den öffentlichen Einreichungen des Unternehmens bei der detaillierten US Securities and Exchange Commission . Die in dieser Pressemitteilung enthaltenen Informationen sind nach dem aktuellen Stand zum Zeitpunkt der Erstausstellung sein. Nach dem Datum dieses Dokuments hält die Gesellschaft nicht die Absicht, eine der vorausschauenden Aussagen zu aktualisieren, um diese Aussagen den tatsächlichen Ergebnissen oder Änderungen in den Erwartungen des Unternehmens entsprechen, sofern dies nicht gesetzlich erforderlich ist.
Iclusig ® ist ein eingetragenes Warenzeichen von ARIAD Pharmaceuticals, Inc.
Quelle: ARIAD Pharmaceuticals, Inc.
ARIAD Pharmaceuticals, Inc.
Für Investoren
Kendra Adams, 617-503-7028
Kendra.adams@ariad.com
oder
Für Medien
Liza heapes, 617-621-2315
Liza.heapes@ariad.com
Wenn die Shortie's dann noch Covern "müßen",
dann ist Weihnachten.
http://finance.yahoo.com/news/...ions-preclinical-data-113500070.html
ARIAD Pharmaceuticals, Inc. ( ARIA ) gab heute die Zeitplan der präklinischen Daten Präsentationen auf der American Association for Cancer Research (AACR) 2015 durchgeführt werden, statt Samstag, 18. April bis Mittwoch, 22. April 2015 in Philadelphia.
Die Zeitplan und Tagungsorte für die vier ARIAD Sitzungen, einschließlich einer mündlichen Präsentation auf der Entdeckung brigatinib (AP26113) mit dem abstrakten Informationen sind nachfolgend aufgeführt:
Titel: Discovery of AP26113, ein potenter, oral wirksamer Inhibitor der anaplastischen Lymphom-Kinase und klinisch relevanten Mutanten
Datum & Zeit: Montag, den 20. April 3: 05-3: 20 Uhr (Oral)
Abstract: # 2827
Ort: Raum 113, Pennsylvania Convention Center
Titel: Ponatinib zeigt Antitumor-Aktivität in retro und FGFR-driven Patienten stammende Fremdtransplantaten
Datum & Zeit: Sonntag, 19. April 1: 00-5: 00 Uhr (Plakat)
Abstract: # 783
Wohnort: Poster § 32
Plakat-Kartennummer: 15
Titel: Die potenten ALK-Inhibitor AP26113 können Mechanismen der Resistenz gegen erste und zweite Generation ALK TKI in präklinischen Modellen überwinden
Datum & Zeit: Sonntag, 19. April 1: 00-5: 00 Uhr (Plakat)
Abstract: # 781
Wohnort: Poster § 32
Plakat-Kartennummer: 13
Titel: EZH2 D1-Domäne Mutanten verleihen erworbener Resistenz gegen EZH2 gezielte Inhibitoren und programmieren B-Zell-Transkriptions
Datum & Zeit: Tuesday, 21. April 08.00 Uhr-12: 12.00 (Poster)
Abstract: # 3597
Wohnort: Poster § 31
Plakat-Kartennummer: 20
Über Iclusig ® (Ponatinibs) Tabletten
Iclusig wird in den USA, der EU, der Schweiz und Australien zugelassen. Iclusig ist ein in den USA für die angegebene Kinase-Hemmer:
Behandlung von erwachsenen Patienten mit T315I-positiver chronisch-myeloischer Leukämie (chronischen Phase, akzelerierte Phase oder Blastenphase) oder T315I-positive Philadelphia-Chromosom-positiver akuter lymphoblastischer Leukämie (Ph + ALL).
Die Behandlung von erwachsenen Patienten mit chronischer Phase, akzelerierte Phase oder Blastenphase chronisch-myeloischer Leukämie oder Ph + ALL, für die keine anderen Tyrosinkinase-Inhibitor (TKI) Therapie angezeigt.
Wichtige Sicherheitsinformationen, EINSCHLIESSLICH DER Warnhinweis
WARNUNG: Gefäßverschluss, Herzversagen und Lebertoxizität
Siehe die vollständige Fachinformation für vollständige Warnhinweis
Gefäßverschluss: Arterielle und venöse Thrombosen und Okklusionen wurden in mindestens 27% eingetreten von Iclusig behandelten Patienten, einschließlich tödlichem Myokardinfarkt, Schlaganfall, Stenose der großen arteriellen Gefäße des Gehirns, schwere periphere arterielle Verschlusskrankheit, und die dringende Notwendigkeit von Revaskularisierung Verfahren. Patienten mit und ohne kardiovaskuläre Risikofaktoren, einschließlich Patienten, die jünger als 50 Jahre alt, erlebt diese Ereignisse. Überwachen auf Anzeichen von Thromboembolien und Gefäßverschluss. Unterbrechen oder stoppen Iclusig sofort für Gefäßverschluss. Eine Nutzen-Risiko-Betrachtung sollte eine Entscheidung Iclusig Therapie neu zu starten führen.
Herzinsuffizienz, einschließlich Todesfälle traten bei 8% der Iclusig behandelten Patienten. Überwachung der Herzfunktion. Unterbrechen oder stoppen Iclusig für neue oder Verschlechterung der Herzinsuffizienz.
Hepatotoxizität, Leberversagen und Tod in Iclusig behandelten Patienten auftraten. Überwachung der Leberfunktion. Unterbrechen Sie Iclusig wenn Hepatotoxizität vermutet wird.
Gefäßverschluss: Arterielle und venöse Thrombosen und Okklusionen, einschließlich tödlichem Myokardinfarkt, Schlaganfall, Stenose der großen arteriellen Gefäße des Gehirns, schwere periphere arterielle Verschlusskrankheit, und die dringende Notwendigkeit von Revaskularisierung Verfahren wurden in mindestens 27% der Iclusig behandelten Patienten auftraten der Phase 1 und Phase 2-Studien. Iclusig kann auch dazu führen wiederkehrende oder Multi-Site-Gefäßverschluss. Insgesamt 20% der Iclusig behandelten Patienten eine arterielle Okklusion und Thrombose Falle einer Klasse. Fatal lebensbedrohlichen Gefäßverschluss und hat innerhalb von 2 Wochen nach Beginn der Behandlung Iclusig und bei Patienten mit durchschnittlichen Tagesdosen Intensitäten so günstig wie 15 mg pro Tag behandelt aufgetreten. Die mediane Zeit bis der erste Gefäßverschluss Veranstaltung zum Auftreten war 5 Monate. Patienten mit und ohne kardiovaskuläre Risikofaktoren Gefäßokklusion erlebt obwohl diese Ereignisse häufiger mit zunehmendem Alter und bei Patienten mit einer Vorgeschichte von Ischämie, Bluthochdruck, Diabetes oder Hyperlipidämie. Unterbrechen oder stoppen Iclusig sofort bei Patienten, die Gefäßverschluss Ereignisse zu entwickeln.
Herzinsuffizienz: Tod und Herzinsuffizienz oder linksventrikulärer Dysfunktion traten bei 5% Iclusig behandelten Patienten (22/449). Acht Prozent der Patienten (35/449) erlebt jeden Grad von Herzinsuffizienz oder linksventrikulärer Dysfunktion. Überwachen Sie Patienten auf Anzeichen und Symptome einer Herzinsuffizienz und zu behandeln, wie es klinisch angezeigt, einschließlich Unterbrechung Iclusig. Betrachten Wegfall Iclusig bei Patienten, die schwere Herzinsuffizienz.
Hepatotoxizität: Iclusig kann Lebertoxizität, einschließlich Leberversagen und zum Tod führen. Fulminantem Leberversagen mit Todesfolge ereignete sich in einer Iclusig behandelten Patienten innerhalb einer Woche nach Beginn Iclusig. Zwei weitere tödliche Fälle von akutem Leberversagen auch aufgetreten. Die Todesfälle traten bei Patienten mit Blastenkrise der CML (BP-CML) oder Philadelphia-Chromosom-positiver akuter lymphoblastischer Leukämie (Ph + ALL). Schwere Lebertoxizität trat bei allen Krankheits Kohorten. Iclusig Behandlung kann in der Höhe in ALT, AST oder beidem führen. Überwachung der Leberwerte bei Studienbeginn, dann zumindest monatlich oder wie klinisch indiziert. Interrupt, Kürzung oder Streichung Iclusig wie klinisch indiziert.
Bluthochdruck: Behandlungsbedingte Hypertonie (auf mindestens einmal definiert als systolischer BP≥140 mm Hg oder diastolischen BP≥90 mm Hg) trat bei 67% der Patienten (300/449). Acht Patienten mit Iclusig (2%) behandelt wurden, behandlungs symptomatischen Bluthochdruck als schwerwiegende Nebenwirkung, auch bei einem Patienten (<1%) mit hypertensive Krise. Die Patienten können dringend klinische Intervention für Bluthochdruck mit Verwirrung, Kopfschmerzen, Schmerzen in der Brust oder Atemnot verbunden erforderlich. Bei 131 Patienten mit Stufe 1 Hypertonie zu Beginn der Studie, 61% (80/131) entwickelt Stufe 2 Hypertonie. Überwachen und während Iclusig Nutzung Blutdruck Erhebungen und zu behandeln, Bluthochdruck, den Blutdruck zu normalisieren. Interrupt, Dosis zu reduzieren oder zu stoppen Iclusig wenn Bluthochdruck ist nicht medizinisch kontrolliert.
Pankreatitis: Klinische Pankreatitis traten bei 6% (28/449) der Patienten (5% Grad 3) mit Iclusig behandelt. Pankreatitis führte zu Abbruch oder Unterbrechung der Behandlung in 6% der Patienten (25/449). Die Inzidenz der Behandlung aufgetretenen Lipase Höhe von 41%. Überprüfen Serumlipase alle 2 Wochen während der ersten 2 Monate, danach monatlich oder wie klinisch indiziert. Betrachten Sie zusätzliche Serumlipase Überwachung bei Patienten mit einer Geschichte von Pankreatitis oder Alkoholmissbrauch. Dosisunterbrechung oder Minderung verlangt werden. In Fällen, in denen Lipase Erhebungen durch Bauchbeschwerden begleitet, zu unterbrechen Behandlung mit Iclusig und Patienten zu bewerten für Pankreatitis. Denke nicht, neu zu starten, bis Iclusig Patienten vollständige Rückbildung der Symptome und Lipase sind weniger als 1,5 x ULN.
Neuropathie: Periphere Neuropathie und Schädel in Iclusig behandelten Patienten auftraten. Insgesamt 13% (59/449) der Iclusig behandelten Patienten eine periphere Neuropathie Falle einer Grad (2% Grad 3/4). In klinischen Studien waren die häufigsten periphere Neuropathien berichtet, periphere Neuropathie (4%, 18/449), Parästhesien (4%, 17/449), Hypästhesie (2%, 11/449) und Hyperästhesie (1%, 5 / 449). Schädel Neuropathie bei 1% (6/449) der Iclusig behandelten Patienten (<1% Grad 3/4) entwickelt. Von den Patienten, die Neuropathie entwickelt, 31% (20/65) entwickelt Neuropathie während des ersten Monats der Behandlung. Überwachen Sie Patienten auf Anzeichen einer Neuropathie, wie Hypästhesie, Hyperästhesie, Parästhesie, Unwohlsein, ein brennendes Gefühl, neuropathischer Schmerz oder Schwäche. Betrachten brechen Iclusig und bewerten, ob Neuropathie vermutet wird.
Ocular Giftigkeit: Schwere Augen Toxizitäten, die zu Blindheit oder Sehstörungen in Iclusig behandelten Patienten auftraten. Retinal Toxizitäten einschließlich Makulaödem, Netzhautvenenverschluss und Netzhautblutungen traten bei 3% des Iclusig behandelten Patienten. Bindehaut oder Hornhautreizung, trockene Augen oder Augenschmerzen traten bei 13% der Patienten. Sehminderung trat bei 6% der Patienten. Andere Augennebenwirkungen gehören Katarakt, Glaukom, Iritis, Iridozyklitis, und Colitis Keratitis. Führen Sie umfassende Augenuntersuchungen zu Beginn und in regelmäßigen Abständen während der Behandlung.
Blutungen: Schwere Blutungen, einschließlich Todesfälle traten in 5% (22/449) der Patienten mit Iclusig behandelt. Hämorrhagische Ereignisse traten bei 24% der Patienten. Die Inzidenz schwerer Blutungen war bei Patienten in der akzelerierten Phase der CML (AP-CML), BP-CML und Ph + ALL. Die meisten hämorrhagischen Ereignisse, aber nicht alle traten bei Patienten mit Grad-4-Thrombozytopenie. Unterbrechen Sie Iclusig für ernsthafte oder schwerwiegende Blutungen und zu bewerten.
Flüssigkeitsretention: Schwere Fälle von Flüssigkeitsretention in 3% (13/449) der Patienten mit Iclusig behandelt aufgetreten. Eine Instanz von Hirnödem war fatal. Insgesamt traten Flüssigkeitsretention in 23% der Patienten. Die häufigsten Fälle von Flüssigkeitsretention waren periphere Ödeme (16%), Pleuraerguss (7%) und Perikarderguss (3%). Überwachen Sie Patienten für Flüssigkeitsretention und Patienten verwalten, wie klinisch indiziert. Interrupt, zu reduzieren oder einzustellen Iclusig wie klinisch indiziert.
Herzrhythmusstörungen: Symptomatische Bradyarrhythmien, die zu einer Voraussetzung für die Schrittmacherimplantation führte trat bei 1% (3/449) der Iclusig behandelten Patienten. Weisen Sie die Patienten auf Anzeichen und Symptome, die auf langsame Herzfrequenz (Ohnmacht, Schwindel oder Schmerzen in der Brust) zu melden. Supraventrikulären Tachyarrhythmien traten bei 5% (25/449) der Iclusig behandelten Patienten. Vorhofflimmern die häufigste supraventrikuläre Tachyarrhythmie und trat bei 20 Patienten. Für 13 Patienten führte die Veranstaltung zu einem Krankenhausaufenthalt. Weisen Sie die Patienten auf Anzeichen und Symptome von Herzrasen (Herzklopfen, Schwindel) zu melden. Unterbrechen Sie Iclusig und bewerten.
Myelosuppression: Schwere (Grad 3 oder 4) Myelosuppression trat bei 48% (215/449) der Patienten mit Iclusig behandelt. Die Häufigkeit dieser Ereignisse war höher bei Patienten mit AP-CML, BP-CML und Ph + ALL als bei Patienten mit CP-CML. Erhalten Blutbild alle 2 Wochen in den ersten 3 Monaten und dann monatlich oder wie klinisch indiziert, und stellen Sie die Dosis so empfohlen.
Tumorlyse-Syndrom: Bei zwei Patienten (<1%) mit fortgeschrittener Erkrankung (AP-CML, BP-CML oder Ph + ALL) mit Iclusig behandelt wurden, entwickelten schweren Tumorlyse-Syndroms. Hyperurikämie traten bei 7% (30/449) der Patienten insgesamt; die meisten hatten CP-CML (19 Patienten). Wegen der Möglichkeit zur Tumorlyse-Syndroms bei Patienten mit fortgeschrittener Erkrankung, für eine ausreichende Flüssigkeitszufuhr und Behandlung von hohem Harnsäurespiegel vor Beginn der Therapie mit Iclusig.
Beeinträchtigt die Wundheilung und Magen-Darm-Perforation: Seit Iclusig kann die Wundheilung beeinträchtigen, unterbrechen Iclusig für mindestens 1 Woche vor einer größeren Operation. Schwere Magen-Darm-Perforation (Fistel) trat bei einem Patienten 38 Tage nach der Cholezystektomie.
Embryofetale Toxizität: Iclusig kann den Fötus schädigen. Wenn Iclusig ist während der Schwangerschaft verwendet werden, oder wenn die Patientin schwanger wird während der Einnahme Iclusig, der Patient sollte über das mögliche Risiko für den Fetus aufgeklärt werden. Frauen beraten, um eine Schwangerschaft zu vermeiden, während der Einnahme Iclusig.
Die häufigsten nicht-hämatologischen Nebenwirkungen: (≥20%) waren Bluthochdruck, Hautausschlag, Bauchschmerzen, Müdigkeit, Kopfschmerzen, trockene Haut, Verstopfung, Gelenkschmerzen, Übelkeit und Fieber. Hämatologische Nebenwirkungen waren Thrombozytopenie, Anämie, Neutropenie, Lymphopenie, Leukopenie und.
Bitte lesen Sie den vollständigen US-Verschreibungsinformationen für Iclusig, einschließlich der Boxed Warning, für zusätzliche wichtige Informationen zur Sicherheit.
Über ARIAD
ARIAD Pharmaceuticals, Inc., mit Hauptsitz in Cambridge, Massachusetts und Lausanne, Schweiz, ist ein integriertes, globales Onkologie-Unternehmen, das sich auf das Leben von Krebspatienten mit Durchbruchs Medikamente verwandeln. ARIAD wird arbeiten an neuen Arzneimitteln, um die Behandlung verschiedener Formen von chronischen und akuten Leukämie, Lungenkrebs und andere schwer zu behandelnde Krebsarten zu fördern. ARIAD nutzt Rechen und strukturelle Ansätze für niedermolekulare Medikamente, die Resistenz gegen bestehende Krebsmedikamente zu überwinden, zu entwerfen. Für weitere Informationen, besuchen Sie http://www.ariad.com oder folgen Sie ARIAD auf Twitter ( ARIADPharm ).
In Kontakt Treten:
ARIAD Pharmaceuticals, Inc.
Für Investoren
Kendra Adams, 617-503-7028
Kendra.adams@ariad.com
oder
Für Medien
Liza heapes, 617-621-2315
Liza.heapes@ariad.com
http://finance.yahoo.com/news/...rma-announce-approval-113500093.html
Cambridge, Mass. Und Petach Tikva Israel - (BUSINESS WIRE) -
ARIAD Pharmaceuticals, Inc. ( ARIA ) und Medison Pharma Ltd, Israels führender internationaler Marketinggruppe für innovative Arzneimittel, gab heute bekannt, dass das israelische Gesundheitsministerium hat die Zulassung für Iclusig in Israel für erwachsene Patienten mit gewährt ® (Ponatinibs):
Chronische Phase, akzelerierte Phase oder Blastenphase chronisch-myeloischer Leukämie (CML), die resistent gegen Dasatinib oder Nilotinib sind, die eine Intoleranz gegen Dasatinib oder Nilotinib und für wen sind nachfolgende Behandlung mit Imatinib klinisch nicht angebracht oder die die T315I Mutation haben
Philadelphia-Chromosom-positiver akuter lymphoblastischer Leukämie (Ph + ALL), die resistent gegen Dasatinib sind, die eine Intoleranz gegen Dasatinib und für wen sind nachfolgende Behandlung mit Imatinib klinisch nicht angebracht oder die die T315I Mutation.
ARIAD hat seinen Antrag auf Iclusig der israelischen Gesundheitsministerium im Juni 2014 Markteinführung des Iclusig wird voraussichtlich im zweiten Quartal 2015 erfolgen.
"Iclusig ist eine wichtige Ergänzung für die Behandlung Arsenal", sagte Professor Arnon Nagler, Leiter der Hämatologie und Knochenmark-Transplantation Abteilung des Chaim Sheba Medical Center in Israel, und der Vorsitzende der israelischen Bone Marrow Transplant Association. Dr. Nagler fügte hinzu: "Die Patienten in Israel haben ein ausgezeichnetes Gesundheitssystem und mit diesem starken und vielversprechendes Medikament ist eine wichtige Ergänzung zu den nationalen Gesundheits Korb."
"Die rasche Genehmigung durch das Ministerium für Gesundheit in Israel spricht für die Bedeutung dieser neuen Therapie für Patienten in Israel anzueignen. Wir freuen uns auf weiteren Erfolg der Arbeit mit ARIAD und Medison Vision zu erfüllen, um innovative und einzigartige Behandlungen von Patienten in Israel bieten ", sagte Meir Jakobsohn, Vorstandsvorsitzender und Gründer von Medison Pharma.
"Wir sind sehr zufrieden mit der schnellen Zulassung von Iclusig in Israel und der Stärke unserer laufenden Zusammenarbeit mit Medison. Dieser Meilenstein erkennt weiter die große Bedeutung der Iclusig für die Behandlung von Patienten mit refraktärer Philadelphia-positiven Leukämien ", so Harvey J. Berger, MD, Vorsitzender und Chief Executive Officer von ARIAD. "Genehmigung in Israel ist ein wichtiger Schritt in unserem Bemühen Iclusig für CML-Patienten in Not in den wichtigsten Regionen der Welt zu machen."
Das Gesundheitsministerium Entscheidung basiert auf den Ergebnissen der Phase-2 PACE basiert (Ponatinib Ph + ALL und CML Evaluation) Studie bei Patienten mit CML oder Ph + ALL, die resistent oder intolerant gegenüber vor Tyrosinkinase-Inhibitor waren (TKI) Therapie oder bei denen die T315I Mutation der BCR-ABL. Iclusig zeigte anti-leukämische Aktivität Erreichen einer gute zytogenetische Remission (MCyR) in 54 Prozent der chronischen Phase der CML-Patienten und bei 70 Prozent der Patienten mit der T315I Mutation 1., 2 MCyR innerhalb der ersten 12 Monate war der primäre Endpunkt der PACE- Studie für Patienten im chronischen Stadium. 1, 2
Bei Patienten mit fortgeschrittener Erkrankung, 57 Prozent der beschleunigten Phase der CML-Patienten und 34 Prozent der Explosionsstadium CML-Patienten erzielten eine große hämatologische Reaktion (MaHR) mit Iclusig. MaHR in den ersten 6 Monaten war der primäre Endpunkt in der Studie für Patienten mit fortgeschrittener Erkrankung. 1, 2
Die häufigsten schweren Nebenwirkungen> 1% waren Pankreatitis, Fieber, Bauchschmerzen, Herzinfarkt, Vorhofflimmern, Anämie, Thrombozytenzahl vermindert, febrile Neutropenie, Herzinsuffizienz, erhöhte Lipase, Atemnot, Durchfall, Neutrophilenzahl vermindert, Panzytopenie und Herzbeutel Erguss.
Serious arteriellen kardiovaskulären, zerebrovaskulären und peripheren Verschlussnebenwirkungen traten bei 6,7%, 5,6% und 5,1% der Iclusig behandelten Patienten. Serious Venenverschluss Reaktionen traten bei 4,5% der Patienten. Die häufigsten (≥20%) Nebenwirkungen jeglichen Schweregrad waren Abnahme der Thrombozytenzahl, Hautausschlag, trockene Haut, und Bauchschmerzen. 2
Basierend auf Orphan Drug Status der Europäischen Arzneimittel-Agentur und die HAEMACARE Projekt, es wird geschätzt, dass es etwa 700 Patienten mit CML in Israel.
Über Iclusig ® (Ponatinibs)
Iclusig ist ein Kinase-Inhibitor ist. Das primäre Ziel für Iclusig ist BCR-ABL, eine abnorme Tyrosinkinase, die bei chronischer myeloischer Leukämie (CML) und Philadelphia-Chromosom-positiver akuter lymphoblastischer Leukämie (Ph + ALL) zum Ausdruck kommt. Iclusig wurde mit Rechen- und strukturbasiertes Wirkstoffdesign-Plattform ARIAD die speziell auf die Aktivität der BCR-ABL hemmen konzipiert. Iclusig Targets nicht nur native BCR-ABL, sondern auch seine Isoformen, Mutationen, die eine Resistenz gegenüber der Behandlung, einschließlich der T315I Mutation, die Resistenz gegenüber anderen zugelassenen TKI zugeordnet wurde tragen.
Wichtige Sicherheitsinformationen, EINSCHLIESSLICH DER Warnhinweis
WARNUNG: Gefäßverschluss, Herzversagen und Lebertoxizität
Siehe die vollständige Fachinformation für vollständige Warnhinweis
Gefäßverschluss: Arterielle und venöse Thrombosen und Okklusionen wurden in mindestens 27% eingetreten von Iclusig behandelten Patienten, einschließlich tödlichem Myokardinfarkt, Schlaganfall, Stenose der großen arteriellen Gefäße des Gehirns, schwere periphere arterielle Verschlusskrankheit, und die dringende Notwendigkeit von Revaskularisierung Verfahren. Patienten mit und ohne kardiovaskuläre Risikofaktoren, einschließlich Patienten, die jünger als 50 Jahre alt, erlebt diese Ereignisse. Überwachen auf Anzeichen von Thromboembolien und Gefäßverschluss. Unterbrechen oder stoppen Iclusig sofort für Gefäßverschluss. Eine Nutzen-Risiko-Betrachtung sollte eine Entscheidung Iclusig Therapie neu zu starten führen.
Herzinsuffizienz, einschließlich Todesfälle traten bei 8% der Iclusig behandelten Patienten. Überwachung der Herzfunktion. Unterbrechen oder stoppen Iclusig für neue oder Verschlechterung der Herzinsuffizienz.
Hepatotoxizität, Leberversagen und Tod in Iclusig behandelten Patienten auftraten. Überwachung der Leberfunktion. Unterbrechen Sie Iclusig wenn Hepatotoxizität vermutet wird.
Gefäßverschluss: Arterielle und venöse Thrombosen und Okklusionen, einschließlich tödlichem Myokardinfarkt, Schlaganfall, Stenose der großen arteriellen Gefäße des Gehirns, schwere periphere arterielle Verschlusskrankheit, und die dringende Notwendigkeit von Revaskularisierung Verfahren wurden in mindestens 27% der Iclusig behandelten Patienten auftraten der Phase 1 und Phase 2-Studien. Iclusig kann auch dazu führen wiederkehrende oder Multi-Site-Gefäßverschluss. Insgesamt 20% der Iclusig behandelten Patienten eine arterielle Okklusion und Thrombose Falle einer Klasse. Fatal lebensbedrohlichen Gefäßverschluss und hat innerhalb von 2 Wochen nach Beginn der Behandlung Iclusig und bei Patienten mit durchschnittlichen Tagesdosen Intensitäten so günstig wie 15 mg pro Tag behandelt aufgetreten. Die mediane Zeit bis der erste Gefäßverschluss Veranstaltung zum Auftreten war 5 Monate. Patienten mit und ohne kardiovaskuläre Risikofaktoren Gefäßokklusion erlebt obwohl diese Ereignisse häufiger mit zunehmendem Alter und bei Patienten mit einer Vorgeschichte von Ischämie, Bluthochdruck, Diabetes oder Hyperlipidämie. Unterbrechen oder stoppen Iclusig sofort bei Patienten, die Gefäßverschluss Ereignisse zu entwickeln.
Herzinsuffizienz: Tod und Herzinsuffizienz oder linksventrikulärer Dysfunktion traten bei 5% Iclusig behandelten Patienten (22/449). Acht Prozent der Patienten (35/449) erlebt jeden Grad von Herzinsuffizienz oder linksventrikulärer Dysfunktion. Überwachen Sie Patienten auf Anzeichen und Symptome einer Herzinsuffizienz und zu behandeln, wie es klinisch angezeigt, einschließlich Unterbrechung Iclusig. Betrachten Wegfall Iclusig bei Patienten, die schwere Herzinsuffizienz.
Hepatotoxizität: Iclusig kann Lebertoxizität, einschließlich Leberversagen und zum Tod führen. Fulminantem Leberversagen mit Todesfolge ereignete sich in einer Iclusig behandelten Patienten innerhalb einer Woche nach Beginn Iclusig. Zwei weitere tödliche Fälle von akutem Leberversagen auch aufgetreten. Die Todesfälle traten bei Patienten mit Blastenkrise der CML (BP-CML) oder Philadelphia-Chromosom-positiver akuter lymphoblastischer Leukämie (Ph + ALL). Schwere Lebertoxizität trat bei allen Krankheits Kohorten. Iclusig Behandlung kann in der Höhe in ALT, AST oder beidem führen. Überwachung der Leberwerte bei Studienbeginn, dann zumindest monatlich oder wie klinisch indiziert. Interrupt, Kürzung oder Streichung Iclusig wie klinisch indiziert.
Bluthochdruck: Behandlungsbedingte Hypertonie (auf mindestens einmal definiert als systolischer BP≥140 mm Hg oder diastolischen BP≥90 mm Hg) trat bei 67% der Patienten (300/449). Acht Patienten mit Iclusig (2%) behandelt wurden, behandlungs symptomatischen Bluthochdruck als schwerwiegende Nebenwirkung, auch bei einem Patienten (<1%) mit hypertensive Krise. Die Patienten können dringend klinische Intervention für Bluthochdruck mit Verwirrung, Kopfschmerzen, Schmerzen in der Brust oder Atemnot verbunden erforderlich. Bei 131 Patienten mit Stufe 1 Hypertonie zu Beginn der Studie, 61% (80/131) entwickelt Stufe 2 Hypertonie. Überwachen und während Iclusig Nutzung Blutdruck Erhebungen und zu behandeln, Bluthochdruck, den Blutdruck zu normalisieren. Interrupt, Dosis zu reduzieren oder zu stoppen Iclusig wenn Bluthochdruck ist nicht medizinisch kontrolliert.
Pankreatitis: Klinische Pankreatitis traten bei 6% (28/449) der Patienten (5% Grad 3) mit Iclusig behandelt. Pankreatitis führte zu Abbruch oder Unterbrechung der Behandlung in 6% der Patienten (25/449). Die Inzidenz der Behandlung aufgetretenen Lipase Höhe von 41%. Überprüfen Serumlipase alle 2 Wochen während der ersten 2 Monate, danach monatlich oder wie klinisch indiziert. Betrachten Sie zusätzliche Serumlipase Überwachung bei Patienten mit einer Geschichte von Pankreatitis oder Alkoholmissbrauch. Dosisunterbrechung oder Minderung verlangt werden. In Fällen, in denen Lipase Erhebungen durch Bauchbeschwerden begleitet, zu unterbrechen Behandlung mit Iclusig und Patienten zu bewerten für Pankreatitis. Denke nicht, neu zu starten, bis Iclusig Patienten vollständige Rückbildung der Symptome und Lipase sind weniger als 1,5 x ULN.
Neuropathie: Periphere Neuropathie und Schädel in Iclusig behandelten Patienten auftraten. Insgesamt 13% (59/449) der Iclusig behandelten Patienten eine periphere Neuropathie Falle einer Grad (2% Grad 3/4). In klinischen Studien waren die häufigsten periphere Neuropathien berichtet, periphere Neuropathie (4%, 18/449), Parästhesien (4%, 17/449), Hypästhesie (2%, 11/449) und Hyperästhesie (1%, 5 / 449). Schädel Neuropathie bei 1% (6/449) der Iclusig behandelten Patienten (<1% Grad 3/4) entwickelt. Von den Patienten, die Neuropathie entwickelt, 31% (20/65) entwickelt Neuropathie während des ersten Monats der Behandlung. Überwachen Sie Patienten auf Anzeichen einer Neuropathie, wie Hypästhesie, Hyperästhesie, Parästhesie, Unwohlsein, ein brennendes Gefühl, neuropathischer Schmerz oder Schwäche. Betrachten brechen Iclusig und bewerten, ob Neuropathie vermutet wird.
Ocular Giftigkeit: Schwere Augen Toxizitäten, die zu Blindheit oder Sehstörungen in Iclusig behandelten Patienten auftraten. Retinal Toxizitäten einschließlich Makulaödem, Netzhautvenenverschluss und Netzhautblutungen traten bei 3% des Iclusig behandelten Patienten. Bindehaut oder Hornhautreizung, trockene Augen oder Augenschmerzen traten bei 13% der Patienten. Sehminderung trat bei 6% der Patienten. Andere Augennebenwirkungen gehören Katarakt, Glaukom, Iritis, Iridozyklitis, und Colitis Keratitis. Führen Sie umfassende Augenuntersuchungen zu Beginn und in regelmäßigen Abständen während der Behandlung.
Blutungen: Schwere Blutungen, einschließlich Todesfälle traten in 5% (22/449) der Patienten mit Iclusig behandelt. Hämorrhagische Ereignisse traten bei 24% der Patienten. Die Inzidenz schwerer Blutungen war bei Patienten in der akzelerierten Phase der CML (AP-CML), BP-CML und Ph + ALL. Die meisten hämorrhagischen Ereignisse, aber nicht alle traten bei Patienten mit Grad-4-Thrombozytopenie. Unterbrechen Sie Iclusig für ernsthafte oder schwerwiegende Blutungen und zu bewerten.
Flüssigkeitsretention: Schwere Fälle von Flüssigkeitsretention in 3% (13/449) der Patienten mit Iclusig behandelt aufgetreten. Eine Instanz von Hirnödem war fatal. Insgesamt traten Flüssigkeitsretention in 23% der Patienten. Die häufigsten Fälle von Flüssigkeitsretention waren periphere Ödeme (16%), Pleuraerguss (7%) und Perikarderguss (3%). Überwachen Sie Patienten für Flüssigkeitsretention und Patienten verwalten, wie klinisch indiziert. Interrupt, zu reduzieren oder einzustellen Iclusig wie klinisch indiziert.
Herzrhythmusstörungen: Symptomatische Bradyarrhythmien, die zu einer Voraussetzung für die Schrittmacherimplantation führte trat bei 1% (3/449) der Iclusig behandelten Patienten. Weisen Sie die Patienten auf Anzeichen und Symptome, die auf langsame Herzfrequenz (Ohnmacht, Schwindel oder Schmerzen in der Brust) zu melden. Supraventrikulären Tachyarrhythmien traten bei 5% (25/449) der Iclusig behandelten Patienten. Vorhofflimmern die häufigste supraventrikuläre Tachyarrhythmie und trat bei 20 Patienten. Für 13 Patienten führte die Veranstaltung zu einem Krankenhausaufenthalt. Weisen Sie die Patienten auf Anzeichen und Symptome von Herzrasen (Herzklopfen, Schwindel) zu melden. Unterbrechen Sie Iclusig und bewerten.
Myelosuppression: Schwere (Grad 3 oder 4) Myelosuppression trat bei 48% (215/449) der Patienten mit Iclusig behandelt. Die Häufigkeit dieser Ereignisse war höher bei Patienten mit AP-CML, BP-CML und Ph + ALL als bei Patienten mit CP-CML. Erhalten Blutbild alle 2 Wochen in den ersten 3 Monaten und dann monatlich oder wie klinisch indiziert, und stellen Sie die Dosis so empfohlen.
Tumorlyse-Syndrom: Bei zwei Patienten (<1%) mit fortgeschrittener Erkrankung (AP-CML, BP-CML oder Ph + ALL) mit Iclusig behandelt wurden, entwickelten schweren Tumorlyse-Syndroms. Hyperurikämie traten bei 7% (30/449) der Patienten insgesamt; die meisten hatten CP-CML (19 Patienten). Wegen der Möglichkeit zur Tumorlyse-Syndroms bei Patienten mit fortgeschrittener Erkrankung, für eine ausreichende Flüssigkeitszufuhr und Behandlung von hohem Harnsäurespiegel vor Beginn der Therapie mit Iclusig.
Beeinträchtigt die Wundheilung und Magen-Darm-Perforation: Seit Iclusig kann die Wundheilung beeinträchtigen, unterbrechen Iclusig für mindestens 1 Woche vor einer größeren Operation. Schwere Magen-Darm-Perforation (Fistel) trat bei einem Patienten 38 Tage nach der Cholezystektomie.
Embryofetale Toxizität: Iclusig kann den Fötus schädigen. Wenn Iclusig ist während der Schwangerschaft verwendet werden, oder wenn die Patientin schwanger wird während der Einnahme Iclusig, der Patient sollte über das mögliche Risiko für den Fetus aufgeklärt werden. Frauen beraten, um eine Schwangerschaft zu vermeiden, während der Einnahme Iclusig.
Die häufigsten nicht-hämatologischen Nebenwirkungen: (≥20%) waren Bluthochdruck, Hautausschlag, Bauchschmerzen, Müdigkeit, Kopfschmerzen, trockene Haut, Verstopfung, Gelenkschmerzen, Übelkeit und Fieber. Hämatologische Nebenwirkungen waren Thrombozytopenie, Anämie, Neutropenie, Lymphopenie, Leukopenie und.
Bitte lesen Sie den vollständigen US-Verschreibungsinformationen für Iclusig, einschließlich der Boxed Warning, für zusätzliche wichtige Informationen zur Sicherheit.
Über Medison
Medison ist Israels führende Marketing-Gruppe, die innovative Nischenhealthcare-Produkten von Unternehmen wie Biogen Idec, Amgen, Shire und Ipsen. Medison wurde gebaut und unterhalten langjährige Beziehungen zu HMOs, örtlichen Kliniken und Ärzten. Drei Generationen Erfahrung in der Healthcare-Industrie seit 1937 unterstützt, ist Medison einzigartig qualifiziert, um das komplette Spektrum an integrierten Dienstleistungen für internationale Unternehmen, die geben oder zu erweitern ihre Präsenz in der israelischen bieten. Medison hat ein Büro und ist sehr auch in Rumänien aktiv. Für weitere Informationen, besuchen www.medisonpharma.com .
Über ARIAD
ARIAD Pharmaceuticals, Inc., mit Hauptsitz in Cambridge, Massachusetts und Lausanne, Schweiz, ist ein integriertes, globales Onkologie-Unternehmen, das sich auf das Leben von Krebspatienten mit Durchbruchs Medikamente verwandeln. ARIAD wird arbeiten an neuen Arzneimitteln, um die Behandlung verschiedener Formen von chronischen und akuten Leukämie, Lungenkrebs und andere schwer zu behandelnde Krebsarten zu fördern. ARIAD nutzt Rechen und strukturelle Ansätze für niedermolekulare Medikamente, die Resistenz gegen bestehende Krebsmedikamente zu überwinden, zu entwerfen. Für weitere Informationen, besuchen Sie http://www.ariad.com oder folgen Sie ARIAD auf Twitter ( ARIADPharm ).
Iclusig ® ist ein eingetragenes Warenzeichen von ARIAD Pharmaceuticals, Inc.
Artikel-Nr:
1. Cortes JE, et al. N Engl J Med. 2013; 369: 1783-1796.
2. ICLUSIG (Ponatinibs) Europäische Zusammenfassung der Produktmerkmale
ARIAD Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen. Alle Aussagen hierin enthaltenen, die nicht Tatsachen der Vergangenheit beschreiben, einschließlich, aber nicht beschränkt auf, Aussagen in Bezug auf: die erwartete Zeitpunkt für die Markteinführung des Iclusig in Israel; das therapeutische und kommerzielle Potenzial von Iclusig; die Stärke unserer Zusammenarbeit mit Medison; und unsere Bemühungen Iclusig in weitere Märkte zu machen, sind in die Zukunft gerichtete Aussagen, die auf gutgläubigen Erwartungen unserer Geschäftsleitung basieren und unterliegen bestimmten Faktoren, Risiken und Unsicherheiten, aufgrund derer die tatsächlichen Ergebnisse, Ausgang von Ereignissen, Timing und Performance unterscheiden sich wesentlich von den ausdrücklich oder impliziert werden. Zu diesen Faktoren, Risiken und Unwägbarkeiten gehören unter anderem: unsere Fähigkeit, in der Herstellung und Lieferung Iclusig auf Medison; die Fähigkeit von Medison, um die vertraglich vereinbarten Leistungen, wie zum Beispiel den Erhalt Preis- und Erstattungszulassung für Iclusig in Israel durchzuführen; Medison der Lage ist, in Israel zu vertreiben, zu fördern, zu vermarkten und zu verkaufen Iclusig; das Niveau der Preisfindung und Erstattung in Israel gewonnen; das Timing und der Erfolg der Umsatz von Iclusig in Israel; die Kosten für unsere Entwicklung und Fertigung, Handel und anderen Aktivitäten verbunden sind; die Angemessenheit der Kapitalausstattung und der Verfügbarkeit zusätzlicher Finanzierung; und diese zusätzlichen Faktoren, die wir in den Einreichungen bei der US Securities and Exchange Commission, einschließlich unseres aktuellen Jahresberichts auf Formular 10-K und nachfolgenden Quartalsberichten auf Formular 10-Q. Sofern nicht anders angegeben, die vorausschauenden Aussagen gelten nur für das Datum dieser Pressemitteilung und wir keine Verpflichtung zur Aktualisierung oder Überarbeitung dieser Aussagen, um Ereignisse oder Umstände, die nach dieser Pressemitteilung eintreten Entwicklungen anzupassen. Wir warnen Investoren sich nicht zu erheblichen Rückgriff auf die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen zu verlassen. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung sind in ihrer Gesamtheit durch diesen Warnhinweis eingeschränkt.
In Kontakt Treten:
Für ARIAD Investoren
Kendra Adams, 617-503-7028
Kendra.adams@ariad.com
oder
Für ARIAD Medien
Liza heapes, 617-621-2315
Liza.heapes@ariad.com
oder
Für Medison
Goldfinger Kommunikation
Lidor Jacob, 972-3-5620024
lidor@goldfingercom.com
Durch Investopedia | 3. April 2015 AAA
http://www.investopedia.com/stock-analysis/040315/...?partner=YahooSA
Ariad Pharmaceuticals (NASDAQ: ARIA) verfügt bereits über eine von der FDA zugelassene Medikament auf dem Markt, aber das bedeutet nicht, es ist immun gegen die Risiken, die jedes Biotech-Lager stehen. Das Unternehmen macht erhebliche Investitionen, die es in die Gewinnzone im Jahr 2018 katapultieren könnte, aber wenn Ariad stolpert, können Anleger im Stich gelassen werden. Hier sind drei wesentliche Risiken, die das Unternehmen, dass die Anleger müssen wissen, zu stellen.
1. Klinische Studie Risiko
Historisch gesehen, 93% der Krebsmedikamente, die Phase 1 der klinischen Forschung geben Versuche nicht, es auf den Markt zu machen. Ariad schlagen die Chancen, wenn durch den Gewinn Zulassung für Iclusig zur Behandlung von zwei seltenen Formen der Leukämie, aber kann sie es wieder tun mit brigatinib?
Ariad ist die Durchführung einer Phase-2-Studie zur Evaluierung brigatinib Fähigkeit, ALK + nicht-kleinzelligem Lungenkrebs Krebs. Untersuchungen zeigen, dass die abnormale Expression ALK in nicht-kleinzelligen Lungenkrebs-Patienten konnte das Onkogen ein primäres Ziel für Krebstherapien zu machen, und als Ergebnis wird brigatinib entworfen, um die Expression von ALK in der Hoffnung, die Beseitigung der Krebs zu hemmen.
Bisher Frühphasen-Studienergebnisse zeigen Anti-Tumor-Aktivität in brigatinib Patienten, stützt dieser faszinierenden Ansatz; aber ist im Frühstadium Daten weit von schlüssig.
Investoren werden zusätzliche Einblicke in brigatinib Wirksamkeit gewinnen, sobald die Phase 2 Ergebnisse gemeldet - wahrscheinlich im Jahr 2016. Sind die Ergebnisse überzeugend genug, schlägt Durchbruch Therapie Bezeichnung, dass eine Einreichung zur FDA-Zulassung konnte kurz darauf kommen, möglicherweise die Weichen für eine offizielle FDA grünes Licht und Produkteinführung brigatinib 2017.
Das Potenzial der Genehmigung eines zweiten Medikaments zu gewinnen, ist eine aufregende Aussicht für Ariad Investoren, aber es ist weit von einem Schloss. Anleger sollten bedenken, dass eine beliebige Anzahl von Dingen kann klinischen Studien entgleisen, und aus diesem Grund, eine Probe stolpern, oder Misserfolg, konnte Ariad Aktien Kokons senden.
2. Bilanzielle Risiko
Nach Angaben der Tufts Center für das Studium der Drug Development, es kostet durchschnittlich $ 1.400.000.000, ein neues Arzneimittel erfolgreich zu entwickeln und das bedeutet, dass schwankenden Biotech-Bilanzen kann ein großes Risiko für die Anleger darstellen.
Auf den ersten Blick erscheint Ariad in OK finanziellen Verfassung, aber Gefahren lauern werden könnte.
Das Unternehmen trat aus dem vierten Quartal mit $ 352.700.000 in bar in die Bücher, aber ein Wandelanleihen bieten im Juni letzten Jahres bedeutet dies auch, hat 346.200.000 $ in langfristige Verbindlichkeiten.
Ausstellende diese Noten gibt Ariad Geld, um ihre Ausgabenpläne zu unterstützen, aber es tut dies mit Kosten verbunden. Das Unternehmen zahlt 3,625% Jahreszins auf die Noten, so dass Zinsaufwendungen des Unternehmens gewachsen ist. Zusätzlich wird, da sind die Schuldverschreibungen im Jahr 2019, und Ariad der Anleitung für Profitabilität im Jahr 2018 hängt von einer Zulassung und Markteinführung von brigatinib im Jahr 2017, ein Versuch Ausfall könnte ein großes Problem auf der Straße darstellen.
Ausgabentempo des Unternehmens ist ein Grund zur Besorgnis, auch. Ariad verbrachte 120.600.000 $ für Forschung und Entwicklung und eine weitere $ 139.800.000 auf Vertriebs-, Verwaltungs- und Gemeinkosten im letzten Jahr. Denn der setzt und nimmt bilanziert werden, berichtete das Unternehmen einen Nettoverlust von $ 162.600.000 im Jahr 2014. Wenn die Ausgaben weiterhin in diesem Tempo und Einnahmen kommt kurz, kann es erheblichen Druck auf Finanzwerte des Unternehmens gestellt, und das könnte bedeuten, weitere Verdünnung zu einem bestimmten Zeitpunkt die Straße hinunter.
3. Wettbewerbsrisiko
Ariad Führung für Iclusig Umsatz zwischen $ 130.000.000 und 140.000.000 $ in diesem Jahr zu erreichen. Das ist solide, aber es ist noch lange nicht schüchtern von Umsatz Ariad Schätzungen der 400.000.000 $ wird es ermöglichen, im Jahr 2018 profitabel zu machen.
Um zu dieser 400.000.000 $ Run-Rate zu erhalten, Ariad setzt auf Iclusig Verkaufssteigen und dem Start von brigatinib. Wenn brigatinib macht es auf den Markt (und es gibt keine Garantie für das), wird es brauchen, um heraus-konkurrieren anderen ALK hemmende Medikamente, darunter Zykadia und Alecensa.
Ariad Phase-2-Studie ist die Bewertung brigatinib Anwendung bei Patienten, die versucht haben und gescheitert an, andere ALK-Inhibitor, sind Xalkori, ein Indiz für die Zykadia gewonnen FDA-Zulassung für im April 2014. Seit dieser anderen ALK-hemmenden Medikamenten durch Tief vermarktet versenkt, große Pharmaunternehmen, Ariad finden konnte, dass es ein Kampf um Marktanteile zu gewinnen.
Zusammen band ihn
Biotechnologie-Aktien tragen mehr als ihren gerechten Anteil an Risiken, und als Folge, sie sind am besten geeignet, um Investoren bereit sind, erhebliche Volatilität und die Möglichkeit eines Verlustes akzeptieren. Ariad ist keine Ausnahme. Die Tatsache, dass Ariad stark rechnet brigatinib, die Ausgaben deutlich und hat wesentliche Schulden sollten Anleger vorsichtig dieses Lager zu machen, und das ist genug, um mich an der Seitenlinie auf diesen einen zu halten, zumindest, bis wir die brigatinib Phase-2-Daten im nächsten Jahr .
Diese $ 19.000.000.000.000 Industrie könnte das Internet zerstören
Eine bleeding-edge Technologie ist im Begriff, das World Wide Web zu Bett gebracht. Und wenn Sie sofort zu handeln, es machen könnte man wild reichen. Experten nennen es die einzige und größte Geschäftschance in der Geschichte des Kapitalismus, The Economist nannte es "transformative", aber Sie werden wahrscheinlich einfach anrufen werde es ", wie ich meine Millionen gemacht." Nicht zu spät, um die Partei nicht - hier klicken, um eine Aktie zu besitzen, wenn der Web erlischt.
Todd Campbell hat keine Position in allen genannten Bestände. Todd besitzt E.B. Capital Markets, LLC. E.B. Kunden Capital kann oder auch nicht haben Positionen in den genannten Unternehmen. Der Motley Dummkopf hat keine Position in einer der genannten Bestände.
Lesen Sie mehr: http://www.investopedia.com/stock-analysis/040315/...px#ixzz3WJxSSEqi
Folgen Sie uns:Investopedia auf Twitter
http://investor.ariad.com/...22&p=irol-newsArticle&ID=2032274
ARIAD verkündet Bewilligung aller Iclusig (wie Ponatinib Hydrochlorid) in Kanada
CAMBRIDGE, Mass. - (BUSINESS WIRE) - April 6, 2015-- ARIAD Pharmaceuticals, Inc. (NASDAQ: ARIA), gab heute bekannt, dass Health Canada hat die Verwendung von Iclusig ™ (als Ponatinibs Hydrochlorid) in zugelassenen Kanada zur Behandlung von erwachsenen Patienten mit allen Phasen der chronisch-myeloischer Leukämie (CML) oder Philadelphia Chromosom-positiver akuter lymphoblastischer Leukämie (Ph + ALL) für die anderen Tyrosinkinase-Inhibitor (TKI) Therapie nicht geeignet ist, einschließlich CML oder Ph + ALL ist, dass ist T315I Mutation positiv ist oder eine vorherige TKI Resistenz oder Unverträglichkeit.
"Patienten mit CML oder Ph + ALL ist resistent gegen die Therapie im Laufe der Zeit", sagte Professor Jeffrey Lipton , Ph.D., MD, Stabsarzt bei Die Prinzessin Margaret Krebszentrum und einer der PACE-Studie Ermittler. "Iclusig eine wertvolle neue Therapieoption sein an Kanada für Patienten mit refraktärer CML und Ph + ALL, wo wir ein bewährtes nicht gedeckten medizinischen Bedarf. "
Iclusig unter der Notice of Compliance with Conditions (NOC / c) eine Regelung genehmigt, basierend auf vielversprechende Hinweise auf klinische Wirksamkeit folgende Rezension durch Health Canada . Produkte im Rahmen dieser Richtlinie zugelassen sind, für die Behandlung, Vorbeugung oder Diagnose einer schweren, lebensbedrohlichen oder stark schwächende Erkrankung gedacht und haben vielversprechende Nutzen gezeigt hat, sind von hoher Qualität und verfügen über ein akzeptables Sicherheitsprofil auf der Basis einer Nutzen / Risiko-Bewertung. Darüber hinaus sind diese Produkte entweder zu einem ernsten medizinischen Bedarf in reagieren Kanada oder haben eine deutliche Verbesserung des Nutzen / Risikoprofils gegenüber bestehenden Therapien zeigten.
"Während der Entwicklung des Iclusig haben wir eng mit führenden akademischen Zentren und klinischen Forschern in arbeitet Kanada . Iclusig ist die einzige, die in TKI genehmigt wurde Kanada für Hinweise darauf, dass CML und Ph + ALL-Patienten mit der T315I Mutation gehören ", erklärte Harvey J. Berger , MD, Vorsitzender und Chief Executive Officer von ARIAD. "Wir werden uns bemühen Iclusig Verfügung so schnell wie möglich, um Patienten mit Ph + Leukämien in ganz Kanada eigen zu machen."
Iclusig wird über kontrollierte Distribution-Programm zur Verfügung gestellt werden. Im Rahmen dieses Programms sind die verordnenden Ärzte, die das Zertifizierungsverfahren abgeschlossen haben, mit Iclusig verschreiben. Geschulte Apotheken der Arzt zertifizierten Status vor der Abgabe Iclusig zum Patienten zu überprüfen.
"Iclusig bietet eine neue Behandlungsoption für Patienten mit schwierig zu behandelnden CML oder Ph + ALL, die zuvor eingeschränkt hatten Therapien zur Verfügung, um sie", sagte Cheryl-Anne Simoneau , President und Chief Executive Officer bei der Chronische myeloische Leukämie-Gesellschaft von Kanada . "Bei geeigneten Patienten kann dies eine wichtige neue Behandlungsoption zu sein."
Die Der Das Health Canada Entscheidung wurde am zweijährigen Daten aus der zulassungsrelevanten Phase-2 PACE-Studie bei Patienten mit CML oder Ph + ALL die resistent oder intolerant waren vor TKI-Therapie, oder wer hatte die T315I Mutation der BCR-ABL-basiert. Iclusig zeigte anti-leukämische Aktivität Erreichen einer gute zytogenetische Remission (MCyR) in 56 Prozent der chronischen Phase der CML-Patienten und bei 70 Prozent der Patienten mit der T315I Mutation. MCyR innerhalb der ersten 12 Monate der Behandlung war der primäre Endpunkt der PACE-Studie für Patienten im chronischen Stadium.
Bei Patienten mit fortgeschrittener Erkrankung, 57 Prozent der beschleunigten Phase der CML-Patienten und 31 Prozent der Explosionsstadium CML-Patienten erzielten eine große hämatologische Reaktion (MaHR) mit Iclusig. MaHR in den ersten 6 Monaten war der primäre Endpunkt in der Studie für Patienten mit fortgeschrittener Erkrankung. Bei Patienten mit Ph + ALL, erreicht 41 Prozent MaHR.
Kommenden Dosisfindungsstudie ARIAD die drei Anfangsdosierungen von Iclusig bei Patienten mit refraktärem, chronische Phase der CML, die resistent gegen mindestens zwei zugelassene TKI sind zu bewerten - geplant für Mitte 2015 beginnen - wird als Zulassungsstudie für das dienen Health Canada die genehmigung.
Über CML und Ph + ALL
CML ist eine Krebserkrankung der weißen Blutkörperchen, die nach dem Chronische myeloische Leukämie-Gesellschaft von Kanada betrifft 1 in 100 Tausend, mit etwa 5.500 Kanadier mit der Krankheit leben. Im Jahr 2010 mehr als 550 Menschen in Kanada wurde erwartet, dass mit CML diagnostiziert werden, und 480 Menschen wurden erwartet, um mit ALL diagnostiziert werden.
CML ist durch eine übermäßige und unregulierte Produktion von weißen Blutkörperchen im Knochenmark auf eine genetische Anomalie, welche die BCR-ABL-Protein produziert wird. Nach einer chronischen Phase der Produktion zu viele weiße Blutkörperchen, CML entwickelt sich in der Regel auf die aggressivere Phasen so genannte beschleunigte Phase und Blastenkrise. Ph + ALL ist ein Subtyp der akuten lymphoblastischen Leukämie, die den Ph + Chromosom, das BCR-ABL produziert trägt. Es hat einen aggressiveren Verlauf als CML und wird oft mit einer Kombination aus Chemotherapie und TKI behandelt. Das BCR-ABL-Protein in diesen beiden Erkrankungen exprimiert.
Über Iclusig ™ (wie Ponatinibs Hydrochlorid)
Iclusig ist ein Kinase-Inhibitor ist. Das primäre Ziel für Iclusig ist BCR-ABL, eine abnorme Tyrosinkinase, die bei chronischer myeloischer Leukämie (CML) ausgedrückt wird, Philadelphia -chromosome positiver akuter lymphoblastischer Leukämie (Ph + ALL). Iclusig wurde mit Rechen- und strukturbasiertes Wirkstoffdesign-Plattform ARIAD die speziell auf die Aktivität der BCR-ABL hemmen konzipiert. Iclusig Targets nicht nur native BCR-ABL, sondern auch seine Isoformen, Mutationen, die eine Resistenz gegenüber der Behandlung, einschließlich der T315I Mutation, die Resistenz gegenüber anderen zugelassenen TKI zugeordnet wurde tragen.
Hinweise
ICLUSIG wird für die Behandlung von erwachsenen Patienten mit chronischer Phase der beschleunigten Phase oder Blastenphase chronisch-myeloischer Leukämie (CML) oder angegeben Philadelphia Chromosom-positiver akuter lymphoblastischer Leukämie (Ph + ALL) für die anderen Tyrosinkinase-Inhibitor (TKI) Therapie nicht geeignet ist, einschließlich CML oder Ph + ALL ist, dass T315I Mutation positiv ist oder eine vorherige TKI Resistenz oder Unverträglichkeit.
Marktzulassung mit Bedingungen auf Antwort Kurs. Es gibt keine Studien, die erhöhte Überlebensrate oder Verbesserung der Symptome mit ICLUSIG. In der Zulassungsstudie, die Mehrzahl der hämatologischen Reaktionen traten innerhalb von 1 Monat. In Erwägung ziehen, wenn ICLUSIG eine hämatologische Reaktion wurde nicht von 3 Monaten (90 Tage) erreicht.
ICLUSIG für diese Indikation erteilt wurde Zulassung mit Bedingungen, bis die Ergebnisse der Untersuchungen zu seiner klinischen Nutzen zu überprüfen. Patienten sollten auf die Bedingtheit der Ermächtigung hingewiesen werden.
Gegenanzeigen
Verwenden Sie in Patienten, die überempfindlich auf Ponatinib oder zu irgendeiner Zutat in der Formulierung oder Bestandteil des Behälters sind. Eine vollständige Liste finden Sie auf der Darreichungsformen ZUSAMMENSETZUNG UND VERPACKUNG Abschnitt der Produkt Monographie.
Nicht bei Patienten, die nicht verwaltete kardiovaskulären Risikofaktoren, einschließlich unkontrollierter Hypertonie haben. Hypertension kann die Gefahr von arteriellen thrombotischen Ereignissen beitragen. Der Blutdruck sollte überwacht und gesteuert, um Bluthochdruck zu vermeiden.
Nicht bei Patienten, die nicht ausreichend mit Flüssigkeit versorgt werden und mit nicht korrigierten hohen Harnsäurespiegel.
Serious Warnhinweise und Vorsichtsmaßnahmen
Iclusig hat schwerwiegende Warnhinweise und Vorsichtsmaßnahmen für: Gefäßverschluss, Herzversagen, Blutungen, Hepatotoxizität, Myelosuppression und Pankreatitis.
ICLUSIG soll nur dann verschrieben und von einem Arzt, der die Zertifizierung mit dem ICLUSIG kontrollierte Verteilung Programm und wer in der Anwendung von antineoplastischen Therapie und bei der Behandlung von CML oder Ph + ALL erlebt Abschluss überwacht werden.
Vascular Occlusion (arterielle und venöse Thrombosen und Okklusionen), trat bei 24% (129/530) der ICLUSIG behandelten Patienten mit und ohne kardiovaskuläre Risikofaktoren (einschließlich der Patienten weniger als 50 Jahre alt). In klinischen Studien ernsthafte Behandlung aufgetretenen arterielle Thrombose (kardiovaskulären, zerebrovaskulären und periphere vaskuläre) und Verschlüsse wurden in 14% der behandelten Patienten ICLUSIG einschließlich tödlicher Myokardinfarkt, tödlich Hirninfarkt, Schlaganfall gesehen, disseminierte intravaskuläre Koagulation und arterielle Stenose manchmal braucht dringende Revaskularisierung Verfahren. Einige dieser Ereignisse traten innerhalb von 2 Wochen nach Beginn der Behandlung mit ICLUSIG. Überwachen auf Anzeichen von Thromboembolien und Gefäßverschluss. Unterbrechen oder zu prüfen, Absetzen in Patienten, die arteriellen thrombotischen Ereignissen zu entwickeln.
Herzinsuffizienz (in einigen Fällen mit tödlichem Ausgang), einschließlich, linksventrikuläre Dysfunktion und Auswurffraktion ab, traten bei 8% der ICLUSIG behandelten Patienten, 5% davon waren schwerwiegend.
Blutung Ereignisse (einige tödlich) einschließlich intrakranielle Blutungen, hämorrhagische Gastritis, (tödlich), hämorrhagische Hirninfarkt (tödlich). Die meisten hämorrhagischen Ereignisse, aber nicht alle, traten bei Patienten mit Grad-4-Thrombozytopenie.
Hepatotoxizität (einschließlich tödlichen akutes Leberversagen) wurde berichtet. Überwachung der Leberfunktion vor und während der Behandlung. Betrachten ICLUSIG Dosisunterbrechung gefolgt von Dosisreduktion oder Absetzen bei Patienten mit Lebertoxizität.
Myelosuppression (Thrombozytopenie, Neutropenie und Anämie).
Pankreatitis (7%) und Erhöhungen der Amylase (2% Grad 3 oder höher) oder Lipase (12% Grad 3 oder höher) wurden berichtet.
ICLUSIG wurde bei Patienten mit eingeschränkter Nierenfunktion untersucht worden.
Die häufigsten Nebenwirkungen
Insgesamt waren die sehr häufige Nebenwirkungen (≥ 10%) Thrombozytenzahl vermindert, Hautausschlag, trockene Haut, Bauchschmerzen, verminderte Neutrophilenzahl, Kopfschmerzen, erhöhte Lipase, Müdigkeit, Verstopfung, Muskelschmerzen, Gelenkschmerzen, Übelkeit, Anämie, ALT erhöht, Bluthochdruck , erhöht und AST.
Über ARIAD
ARIAD Pharmaceuticals, Inc. Mit Sitz in Cambridge, Massachusetts und Lausanne . Schweiz , Ist ein integriertes, globales Onkologie-Unternehmen auf das Leben von Krebspatienten mit Durchbruchs Medikamente Umwandlung konzentriert. ARIAD wird arbeiten an neuen Arzneimitteln, um die Behandlung verschiedener Formen von chronischen und akuten Leukämie, Lungenkrebs und andere schwer zu behandelnde Krebsarten zu fördern. ARIAD nutzt Rechen und strukturelle Ansätze für niedermolekulare Medikamente, die Resistenz gegen bestehende Krebsmedikamente zu überwinden, zu entwerfen. Für weitere Informationen, besuchen Sie http://www.ariad.com oder folgen Sie ARIAD auf Twitter ( ARIADPharm ).
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen. Alle Aussagen hierin enthaltenen, die nicht Tatsachen der Vergangenheit beschreiben, einschließlich, aber nicht beschränkt auf, Aussagen über: das therapeutische Potenzial von Iclusig und der Zeitpunkt der Herstellung Iclusig in Kanada ; der erwartete Zeitpunkt für den Beginn einer Zulassungsstudie für diese Genehmigung in Kanada ; und unsere Bemühungen, neue Krebsbehandlungen verwandt sind, sind zukunftsgerichtete Aussagen, die auf Treu und Glauben die Erwartungen des Managements beruhen und mit Risiken und Unsicherheiten, welche die tatsächlichen Ergebnisse wesentlich von den in solchen vorausschauenden Aussagen abweichen können. Zu diesen Faktoren, Risiken und Unsicherheiten beinhalten, sind aber nicht beschränkt auf, unsere Fähigkeit, Preisfindung und Erstattung Zulassung für Iclusig in zu erhalten, begrenzt Kanada und die Höhe einer solchen Preisgestaltung und Erstattung, einschließlich der Erstattung von Dritten; Nach Markt regulatorischen Anforderungen; das Auftreten ungünstiger Sicherheitsereignisse mit unseren Produkten; unsere Fähigkeit, erfolgreich zu vertreiben, zu fördern, zu vermarkten und zu verkaufen Iclusig in Kanada ; weitere klinische Studien mit Iclusig, einschließlich unserer Zulassungsstudie für diese Genehmigung kann negativ oder nicht eindeutig Ergebnissen führen oder nicht begonnen oder rechtzeitig durchgeführt werden; die Kosten für Entwicklung und ARIAD, gewerblichen und anderen Aktivitäten verbunden sind; unsere Fähigkeit zu erhalten und zu schützen Iclusig an geistigem Eigentum; die Tatsache, dass Wirkstoffforschung und -entwicklung ist komplex, zeitaufwendig, teuer und birgt ein hohes Risiko des Scheiterns; technische Schwierigkeiten, übermäßig hohe Kosten oder andere Themen im Zusammenhang mit der Herstellung oder Lieferung von Iclusig; die Angemessenheit der Kapitalausstattung und der Verfügbarkeit zusätzlicher Finanzierung; und anderen Faktoren in den öffentlichen Einreichungen des Unternehmens bei der detaillierten US Securities and Exchange Commission . Die in dieser Pressemitteilung enthaltenen Informationen sind nach dem aktuellen Stand zum Zeitpunkt der Erstausstellung sein. Nach dem Datum dieses Dokuments hält die Gesellschaft nicht die Absicht, eine der zukunftsgerichteten Aussagen zu aktualisieren, um sie an tatsächliche Ergebnisse oder Veränderungen in den Erwartungen der Gesellschaft, soweit nicht gesetzlich erforderlich anzupassen.
Iclusig ™ ist ein Warenzeichen von ARIAD Pharmaceuticals, Inc.
Quelle: ARIAD Pharmaceuticals, Inc.
Für ARIAD Investoren
Kendra Adams, 617-503-7028
Kendra.adams@ariad.com
oder
Für ARIAD Medien
Liza heapes, 617-621-2315
Liza.heapes@ariad.com
http://www.shortanalytics.com/getsecfiling.php?tsymbol=aria
Ariad Pharmaceuticals, Inc. (ARIA), Amgen, Inc. (AMGN): Wie Sarissa Capital Top Picks Schlagen Sie die Markt
Durch Swapna Chalasani in Hedge Fonds , Nachrichten
Veröffentlicht am: 15. April 2015 um 02.41 Uhr
http://www.insidermonkey.com/blog/...op-picks-beat-the-market-343015/
Mit Hauptsitz in Connecticut, wurde Sarissa Capital Management gegründet von Alexander J. Denner im Jahr 2012. Zuvor war Herr Denner als Portfolio Manager bei Andreas Halvorsens Viking Globale und als Senior Managing Director bei Carl Icahn Icahn Capital LP. Sarissa Capital Management Investitionen sind vor allem in der Gesundheitsbranche, wie der neuesten 13F Einreichung zeigte.
image: http://cdn2.insidermonkey.com/blog/wp-content/...Capital1-424x600.jpg
Alex Denner Sarissa Kapital
Als Teil unserer Small-Cap-Strategie, analysieren wir die Aktienportfolios von über 700 Hedge-Fonds und Identifizierung der beliebtesten Unternehmen unter ihnen mit einer Marktkapitalisierung zwischen $ 1,0 und $ 5,0 Milliarden. Die Strategie wird von starken Backtest-Ergebnisse, die zeigten, dass ein Portfolio der 15 beliebtesten Small-Cap-Picks unter den Hedge-Fonds gelungen, den Markt um 1,0 Prozentpunkte pro Monat übertreffen unterstützt, während die beliebtesten Large-Cap-Picks schlechter als der Markt rund 7,0 Basispunkte. Ein weiterer Punkt, den Erfolg unserer Strategie unterstützt werden die Gewinne von 132% in den letzten 2,5 Jahre, die den S & P 500 ETF (SPY) zu schlagen 's Renditen um rund 80 Prozentpunkte ( lesen Sie hier mehr dazu ).
Werfen wir einen genaueren Blick auf einige der Positionen im Aktienportfolio Sarissa Capital, mit dem Fonds Top fünf Picks Entsendung eine durchschnittliche Rendite von 8% im ersten Quartal 2015, während der S & P 500 ETF (SPY) während das kroch bis 0,9% Vergleichszeitraum. Nach seiner letzten 13F Ariad Pharmaceuticals, Inc. (NASDAQ: ARIA ), Quest Diagnostics Inc. (NYSE: DGX ) und Amgen, Inc. (NASDAQ: AMGN ) blieben die ersten drei Plätze des Fonds.
(: ARIA NASDAQ), einer globalen Onkologie-Unternehmen, in dem der Anleger beteiligt ist gleich 31,24% seines Aktienportfolios größten Anteil Sarissa Capital wird von Ariad Pharmaceuticals, Inc. vertreten. Die Position enthält fast 12.850.000 Aktien, auf 88.280.000 $ bewertet, der von Ende 2014 verzeichnete das Unternehmen einen siebenfachen Steigerung des Umsatzes im vierten Quartal 2014 auf 67 Millionen US-Dollar und verengte seine Nettoverlust auf $ 0,03 pro Aktie, verglichen mit einem Netto Verlust von $ 0,40 je Aktie für den gleichen Zeitraum des Vorjahres. Inmitten der Nachrichten, die Aktien des Unternehmens von 19,94% im ersten Quartal 2015. Weitere wichtige Investoren, die aus Wetten auf Ariad Pharmaceuticals profitiert sammelten sind Sprichwort Capital Management hält 8.300.000 Aktien und Stephen Dubois Camber Capital Management, den Besitz 7.500.000 Aktien.
Read more at https://translate.googleusercontent.com/...T0PfjA#l2VoCh52u1tl4UDV.99
http://finance.yahoo.com/news/...updated-clinical-data-113500971.html
GENF & CAMBRIDGE, Mass .-- (BUSINESS WIRE) -
ARIAD Pharmaceuticals, Inc. ( ARIA ) gab heute bekannt, klinischen Daten über seine Untersuchungs Tyrosinkinase-Inhibitor, aktualisiert brigatinib (AP26113), bei Patienten mit anaplastischen Lymphom-Kinase-positive (ALK +) von fortgeschrittenem nicht-kleinzelligem Lungenkrebs (NSCLC) aus einer laufenden Phase-1- / 2-Studie. Die neuen Ergebnisse eine Analyse der Sicherheit und Wirksamkeit für Patienten in ausgewählten Dosen brigatinib behandelt und eine Bewertung der intrakraniale zentralen Nervensystems (ZNS), die Antitumoraktivität.
Die aktualisierten Ergebnisse wurden auf dem 2015 European Lung Cancer Conference (ELCC) in Genf in der Schweiz vorgestellt.
Phase 2 Dosis Sub-Analyse
Die bei ELCC präsentierten Daten konzentrierte sich auf die 98 Patienten in Dosierungen von 90 mg / Tag behandelt wurden (n = 18), 90 mg / Tag für 1 Woche, gefolgt von Eskalations bis 180 mg / Tag (n = 32) und 180 mg / Tag (n = 48) in der Phase-2-Teil der Studie. Alle Patienten, die diese Dosen wurden für die Sicherheit von Patienten mit ALK + NSCLC (n = 65) wurden auf ihre Wirksamkeit bewertet ausgewertet und. Die Präsentation auf ELCC basiert auf Patientendaten, wie der 19. Januar 2015 mit einem medianen Follow-up von 40 Wochen (- 150 + Wochen Bereich, 0,1) auf.
"Die aktualisierten Daten auf ausgewählten Dosierungen der Phase-1/2-Studie zeigen, robuste Anti-Tumor-Aktivität von brigatinib bei Patienten mit crizotinib feste ALK + NSCLC, mit Antworten nähern uns einem Jahr", sagte Rafael Rosell, MD, Director, Cancer Biology & Precision Medicine Programm katalanischen Institut für Onkologie, Deutschen Trias i Pujol Health Sciences Institute und Hospital in Barcelona, Spanien. "Wichtig ist, indem Sie in der 90-mg-Dosis, haben wir eine Reduzierung der frühen Beginn an den höhere Anfangsdosis beobachtet pulmonale Ereignisse gesehen."
Schlüsseldaten aus der Studie Update enthalten:
Zusammenfassung sicherheits
Die häufigsten unerwünschten Ereignisse (UE) jeder Klasse, unabhängig von der Behandlung Beziehung, waren Übelkeit, Durchfall und Müdigkeit und waren in Häufigkeit in allen drei Dosis-Kohorten, wie folgt:
Bei 90 mg / Tag (n = 18): Übelkeit (44%), Kopfschmerzen (44%), Durchfall (39%), Müdigkeit (39%), Husten (39%) und erhöhte Amylase (33%)
Bei 90 mg bis 180 mg / Tag (n = 32): Diarrhoe (44%), Übelkeit (41%), Müdigkeit (38%), Kopfschmerzen (28%), Husten (28%) und erhöhte Amylase (28% )
Bei 180 mg / Tag (n = 48): Übelkeit (63%), Diarrhoe (38%), Müdigkeit (31%), Kopfschmerzen (31%), Husten (25%) und erhöhte Amylase (15%)
Schwerwiegende UE, unabhängig von der Behandlung Beziehung, in 4% oder mehr Patienten auftreten, waren Dyspnoe, Hypoxie und Lungenentzündung, wie folgt:
Bei 90 mg / Tag (n = 18): Dyspnoe (1 Patient, 6%), Hypoxie (2 Patienten, 11%) und Pneumonie (2 Patienten, 11%)
Bei 90 mg bis 180 mg / Tag (n = 32): Dyspnoe (2 Patienten, 6%), Hypoxie (1 Patient, 3%) und Pneumonie (1 Patient, 3%)
Bei 180 mg / Tag (n = 48): Dyspnoe (2 Patienten, 4%), Hypoxie (2 Patienten, 4%) und Pneumonie (2 Patienten, 4%)
Wie bereits festgestellt und gemeldet, weniger früh einsetzende Lungen Veranstaltungen, darunter Dyspnoe, Hypoxie, und neue Lungentrübungen, wurden mit einer Anfangsdosis von 90 mg (2/50 Patienten, 4%) im Vergleich zu 180 mg berichtet (6/44 Patienten , 14%). Wichtig ist, dass keine früh einsetzende pulmonale Ereignisse in der 32 Patienten beobachtet begann um 90 mg und eskalierte zu 180 mg nach 7 Tagen.
Beantwortungsübersicht
Die mediane Zeit bis zum Studium für Patienten mit 90 mg Dosierung / Tag betrug 33,5 Wochen (Bereich von 0,7 bis 150 + Wochen), 50,3 Wochen (Bereich von 0,1 bis 70 + Wochen) für die 90 mg bis 180 mg / Tag Kohorte und 31,4 Wochen (Bereich von 0,1 bis 135 + Wochen) für die 180 mg / Tag Kohorte.
Brigatinib war bei jedem der drei Dosierungen mit ähnlicher Wirksamkeit unter den Kohorten aktiv:
Objektive Ansprechrate (ORR) unter den 14 auswertbaren ALK + NSCLC-Patienten mit 90 mg / Tag dosiert betrug 79% (11 Patienten, 7 bestätigt).
Unter den 26 auswertbaren ALK + NSCLC-Patienten bei 90 mg / Tag für 1 Woche, gefolgt von 180 mg / Tag dosiert wurde ORR 81% (21 Patienten, 19 bestätigt) einschließlich 3 Patienten (12%) mit einer kompletten Remission (CR).
Unter den 25 auswertbaren ALK + NSCLC-Patienten mit 180 mg / Tag verabreicht wurde ORR 68% (17 Patienten, 16 bestätigt), darunter 2 Patienten (8%) mit einem CR.
Die mediane Dauer des Ansprechens betrug 11,2 Monate für die 90 mg / Tag Kohorte, noch nicht für die 90 mg bis 180 mg / Tag Kohorte und 9,2 Monate für die 180 mg / Tag Kohorte erreicht.
Das mediane progressionsfreie Überleben (PFS) betrug 12,9 Monate für die 90 mg / Tag Kohorte, noch nicht für die 90 mg bis 180 mg / Tag Kohorte, und 11,1 Monate für die 180 mg / Tag Kohorte erreicht.
Phase 1/2 Analyse von ZNS-Antitumor-Aktivität
Eine gesonderte Bewertung der Wirksamkeit und Sicherheit von brigatinib in ALK + NSCLC Patienten mit intrakraniellen ZNS-Metastasen zu Beginn der Studie wurde auch auf der Tagung vorgestellt ELCC. In einer unabhängigen zentralen radiologischen Beurteilung der Hirnmagnetresonanztomographie (MRT), identifiziert 49 von 79 ALK + NSCLC-Patienten in der Phase 1/2 Studie haben intrakranielle ZNS-Metastasen zu Beginn der Studie. Von diesen 49 Patienten, 16 hatten messbare Hirn ZNS-Metastasen (15 auswertbaren) und 33 Patienten hatten nur nicht messbare Hirn ZNS-Metastasen (30 auswertbar).
AEs bei Patienten mit ZNS-Metastasen traten bei einer ähnlichen Häufigkeit wie im weiteren Studienpopulation.
In diesem Post-hoc-Analyse der zentral überprüft Gehirn-MRT zeigte brigatinib intrakranielle ZNS-Antitumor-Aktivität mit Antworten in ALK + NSCLC Patienten mit intrakraniellen ZNS-Metastasen zu Beginn der Studie.
Objektive Ansprechrate (ORR) war 53% in auswertbaren Patienten mit messbaren Läsionen (n = 15), davon 1 (7%) CR.
In auswertbaren Patienten mit nicht messbaren Läsionen (n = 30), definiert als ORR Verschwinden aller Läsionen betrug 30% (9 Patienten).
Für Patienten mit einer Antwort und mindestens ein Follow-up-MRT-Untersuchung (n = 16), mittlere (Kaplan-Meier [KM] Schätzung) Dauer der intrakraniellen Antwort war 18,9 Monate. Für Patienten mit einem Follow-up-MRT-Untersuchung (n = 45), mittlere (KM Schätzung) intrakranielle PFS betrug 22,3 Monate.
Die mediane Zeit zum Studium für ALK + NSCLC Patienten mit intrakraniellen ZNS-Metastasen bei Studienbeginn war 56,1 Wochen (Bereich von 0,1 bis 150 + Wochen).
Zulassungsrelevanten Phase-2 ALTA Test Einschreibung Patienten
Eine separate, pivotale globale Phase-2-Studie mit brigatinib (AP26113) bei Patienten mit lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Lungenkrebs, die ALK + auf crizotinib fortgeschritten sind weiterhin Patienten umfassen. Die ALTA (A LK in L ung Cancer T rial von A P26113) Studie soll die Sicherheit und Wirksamkeit von AP26113 in feuerfeste ALK + NSCLC-Patienten zu bestimmen. Die Studie wird etwa 220 Patienten, einschließlich Menschen mit Hirnmetastasen anmelden. Patienten werden 1: 1 randomisiert, um entweder 90 mg brigatinib einmal pro Tag kontinuierlich empfangen oder eine Blei-Dosis von 90 mg / Tag für 7 Tage, gefolgt von 180 mg / Tag kontinuierlich.
"Wir sind auf dem richtigen Weg für die vollständige Patientenaufnahme in die ALTA Studie im dritten Quartal dieses Jahres", so Frank G. Haluska, MD, Ph.D., Senior Vice President der klinischen Forschung und Entwicklung und Chief Medical Officer bei ARIAD. "Wir sind von der ZNS-Antitumor-Aktivität ermutigt, jetzt mehr als 18 Monate in der Phase 1/2 Studie brigatinib, und freuen uns auf die Bewertung der Aktivitäten auf Hirnmetastasen in der ALTA-Studie."
Über ARIAD
ARIAD Pharmaceuticals, Inc., mit Hauptsitz in Cambridge, Massachusetts und Lausanne, Schweiz, ist ein integriertes, globales Onkologie-Unternehmen, das sich auf das Leben von Krebspatienten mit Durchbruchs Medikamente verwandeln. ARIAD wird arbeiten an neuen Arzneimitteln, um die Behandlung verschiedener Formen von chronischen und akuten Leukämie, Lungenkrebs und andere schwer zu behandelnde Krebsarten zu fördern. ARIAD nutzt Rechen und strukturelle Ansätze für niedermolekulare Medikamente, die Resistenz gegen bestehende Krebsmedikamente zu überwinden, zu entwerfen. Für weitere Informationen, besuchen Sie http://www.ariad.com oder folgen Sie ARIAD auf Twitter ( ARIADPharm ).
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen. Alle Aussagen hierin enthaltenen, die nicht Tatsachen der Vergangenheit beschreiben, einschließlich, aber nicht beschränkt auf, Aussagen über: aktualisierten klinischen Daten für brigatinib und wann voraussichtlich für den Abschluss Einschreibung in unsere ALTA klinischen Studie, sind zukunftsgerichtete Aussagen, die auf den Erwartungen des Managements beruhen und unterliegen bestimmten Faktoren, Risiken und Unsicherheiten, aufgrund derer die tatsächlichen Ergebnisse, Ausgang von Ereignissen, Timing und Performance erheblich von den ausdrücklich oder Aussagen abweichen. Zu diesen Faktoren, Risiken und Unwägbarkeiten gehören unter anderem: präklinische Daten und frühen klinischen Daten dürfen nicht in den späteren Phasen der klinischen Studien repliziert werden; die Kosten für Forschung, Entwicklung, Herstellung und andere Aktivitäten verbunden sind; die Angemessenheit unserer Kapitalausstattung und der Verfügbarkeit zusätzlicher Finanzierung; unsere laufenden und weiteren klinischen Studien mit brigatinib möglicherweise nicht erfolgreich oder initiiert, eingeschrieben oder rechtzeitig durchgeführt werden; regulatorische Entwicklungen und Sicherheitsfragen; Wettbewerbsrisiken; Fertigungsprobleme und diese zusätzlichen Faktoren, die wir in den Einreichungen bei der US Securities and Exchange Commission, einschließlich unseres aktuellen Jahresberichts auf Formular 10-K und nachfolgenden Quartalsberichten auf Formular 10-Q. Sofern nicht anders angegeben, die vorausschauenden Aussagen gelten nur für das Datum dieser Pressemitteilung und wir keine Verpflichtung zur Aktualisierung oder Überarbeitung dieser Aussagen, um Ereignisse oder Umstände, die nach dieser Pressemitteilung eintreten Entwicklungen anzupassen. Wir warnen Investoren sich nicht zu erheblichen Rückgriff auf die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen zu verlassen. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung sind in ihrer Gesamtheit durch diesen Warnhinweis eingeschränkt.
Kontakt:
ARIAD Pharmaceuticals, Inc.
Für Investoren
Kendra Adams, 617-503-7028
Kendra.adams@ariad.com
oder
Für Medien
Liza heapes, 617-620-4888
Liza.heapes@ariad.com