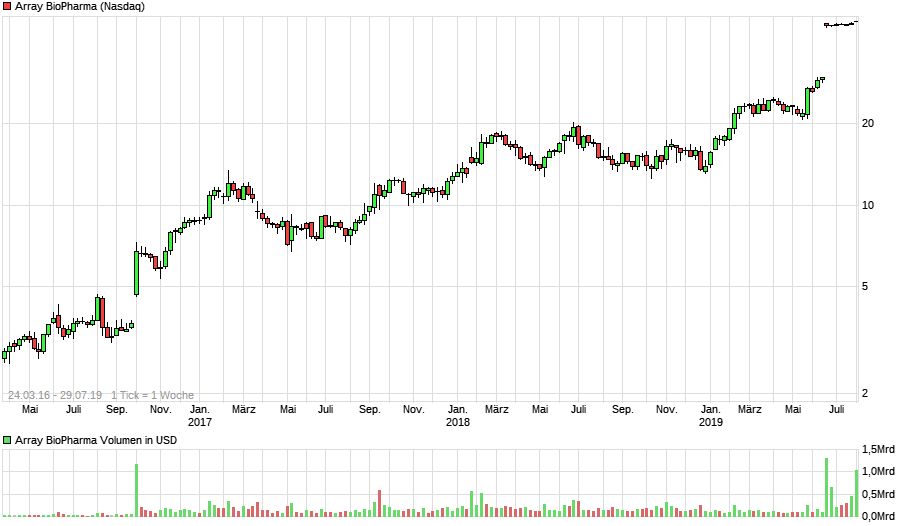
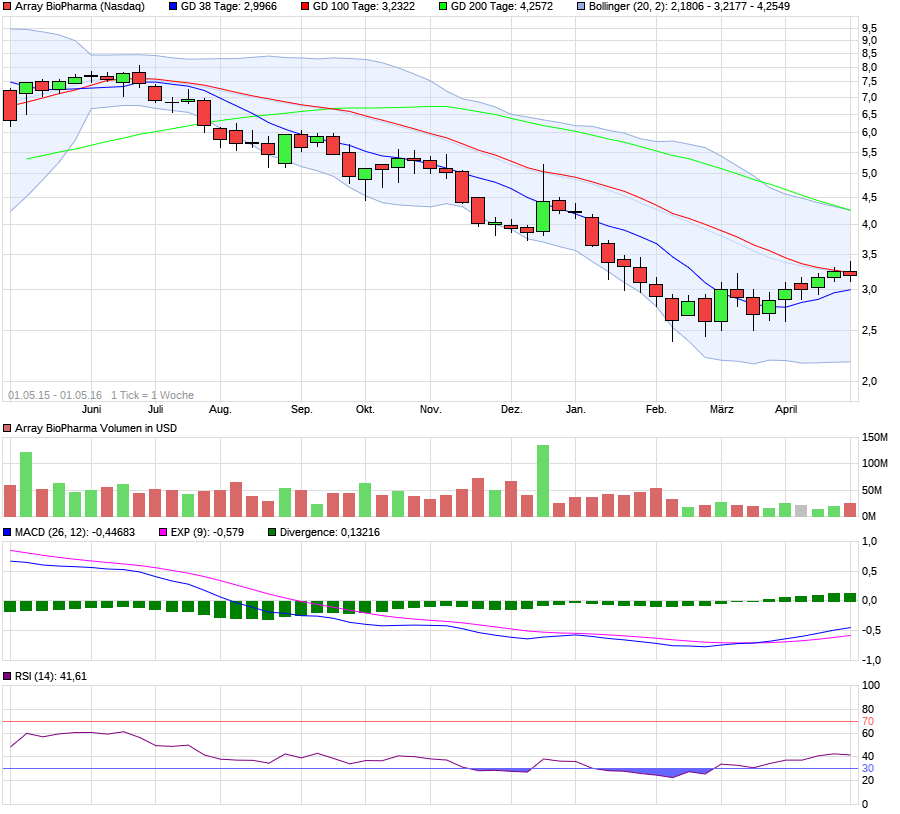
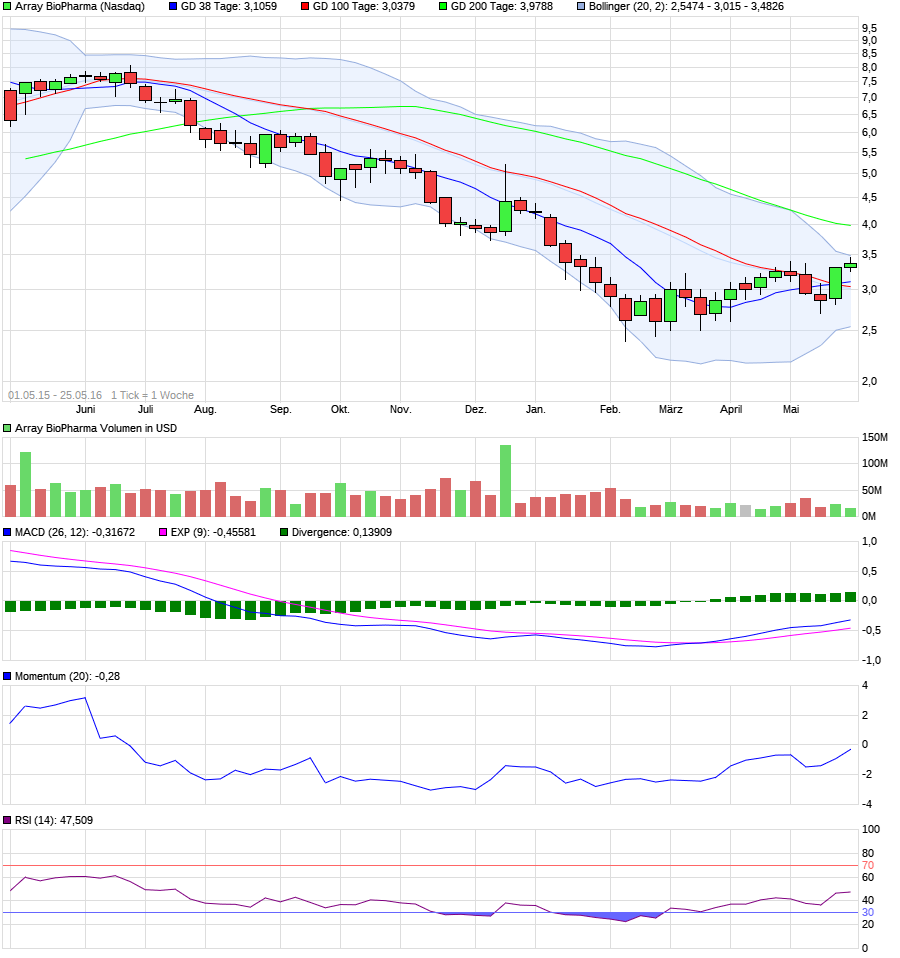
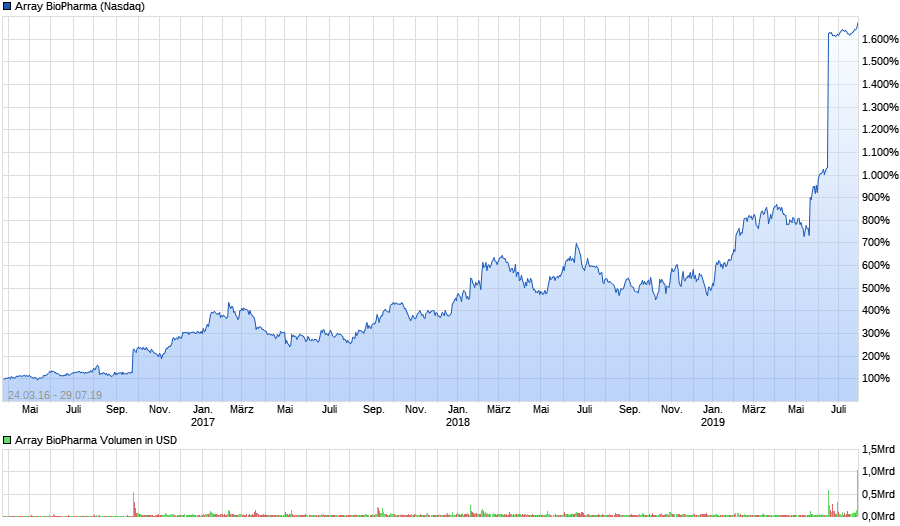
Highflyer 2016?
Array BioPharma Inc.
3200 Walnut Street
Boulder, CO 80301
United States - Map
Phone: 303-381-6600
Website: http://www.arraybiopharma.com
http://www.ariva.de/news/...-for-Pharma-Companion-Diagnostics-5610442
Germantown , Maryland und Hilden, Deutschland, 11. Januar 2016 / PRNewswire / -
QIAGEN NV (NASDAQ: QGEN; Frankfurt, Prime Standard: QIA) gab heute bekannt, einen Meilenstein in seinem Portfolio von Master-Kooperationsvereinbarungen mit führenden Pharmaunternehmen und eine Rekordzahl an neuen Projekten im Jahr 2015 für die gemeinsame Entwicklung von Companion Diagnostics erreicht hatte.
Unter der Rekordzahl von neuen Projekten war der Beginn eines Master - Kooperationsvereinbarung mit Array BioPharma (NASDAQ: ARRY), die der 15. Pharmapartner wurde mit QIAGEN auf diesen umfassenden Vereinbarungen zu arbeiten , die mehrere Projekte abdecken.
Ein erstes Projekt mit Array wird ein QIAGEN molekulardiagnostische Test mit binimetinib, einen neuartigen MEK - Inhibitor derzeit in Phase III der klinischen Studien zur Anwendung bei Patienten mit den NRB-mutierten Melanomen gepaart zu entwickeln und zu vermarkten. Diese diagnostischen Begleittests laufen auf dem Rotor-Gene Q MDx, einer PCR-Plattform, die ein Mitglied der modularen QIAsymphony Familie von Automatisierungslösungen ist.
"Wir sind sehr erfreut über die Partnerschaft mit Array BioPharma zu therapiebegleitende Diagnostika für ihre zielgerichtete Therapien zu entwickeln. Die Tatsache, dass so viele Pharma- und Biotech-Unternehmen mit QIAGEN für diese gemeinsame Entwicklungsprojekte beigetreten sind, darunter fünf auf der Basis unserer innovativen Flüssigkeit Biopsieprobe Technologies mit molekulare Erkenntnisse aus dem Blut zu gewinnen, das Vertrauen in unsere Probe zu Insight - Lösungen unterstreicht " , sagte Peer M. Schatz, Vorstandsvorsitzender von QIAGEN. "Diese Zusammenarbeit hält das Versprechen auf die Ergebnisse für Krebspatienten zu verbessern, die gesamte Palette von QIAGEN-Plattformen beinhalten, das GeneReader NGS-System insbesondere die Ende 2015 als erste wirklich komplette Workflow mit der nächsten Generation Sequenzierung ins Leben gerufen wurde."
http://www.arraybiopharma.com/clinical-trials/
http://www.nasdaq.com/press-release/...mmercialization-20160331-00500
PR Newswire, 31. März 2016 09.00.00 EDT
- Array auf $ 12 Millionen Einmalzahlung erhalten und bis zu 64.000.000 $ in weitere Entwicklung und Vermarktung Meilensteine, darunter bis zu zweistellige Lizenzgebühren auf zukünftige Verkäufe -
- Array behält die volle Vermarktungsrechte für alle Verbindungen, die in allen Indikationen in Gebieten außerhalb von Asien und innerhalb Asiens behält die vollen Rechte an Krebsindikationen für alle Verbindungen mit Ausnahme derjenigen von Asahi Kasei Pharma entwickelt -
BOULDER, Colo und TOKIO, 31. März 2016 / PRNewswire / - Array BioPharma Inc.. (Nasdaq: ARRY ) und Asahi Kasei Pharma Corporation hat heute eine strategische Zusammenarbeit wählen Tropomyosin Rezeptorkinase A (TrkA) Inhibitoren zur Entwicklung und Vermarktung, einschließlich Array-erfunden ARRY-954, für Schmerzen, Entzündungen und andere nicht-Krebs-Indikationen. Array behält sich das Recht für alle Verbindungen für alle Indikationen außerhalb Asiens. Innerhalb Asiens Array behält sich das Recht auf Krebsindikationen für alle Verbindungen, mit Ausnahme derjenigen Verbindungen, die durch Asahi Kasei Pharma entwickelt, einschließlich ARRY-954.
TrkA ist die höchste Affinität für den Rezeptor Nerve Growth Factor (NGF) und wird häufig auf peripheren Schmerz Abfühlen Neuronen exprimiert. Die Aktivierung des TrkA Weg durch NGF wurde in der Pathogenese vieler schwieriger zu behandeln menschlichen Schmerzzuständen wie Arthrose Schmerzen, chronischen Rückenschmerzen, diabetische periphere Neuropathie, Krebsschmerzen und interstitielle Zystitis verwickelt. Präklinische Studien haben gezeigt, dass die NGF / TrkA Signalisierungs Achse mit kleinen Molekül-Inhibitoren die peripheren Schmerzreaktionen in relevanten in-vivo-Modellen blockiert eine Vielzahl von hohen ungedeckten Bedarf Bedingungen menschlichen Schmerz darstellt.
ARRY-954 ist ein potenter, oral verfügbarer, niedermolekularer Inhibitor von TrkA. Aufgrund ihrer allosterischen Mechanismus der TrkA Hemmung, ARRY-954 erreicht eine sehr hohe Selektivität gegenüber anderen Mitgliedern der Trk-Kinase-Familie sowie andere Off-Target-Kinasen. In präklinischen Studien hat ARRY-954 Hemmung der peripheren Schmerzreaktionen zeigten in einer Vielzahl von in-vivo-Modellen darstellen schwierig menschliche Schmerzzustände zu behandeln.
Gemäß den Bedingungen der Vereinbarung, Array wird eine Vorauszahlung in Höhe von $ 12.000.000, erhalten das Recht auf 64.000.000 $, wenn bestimmte Entwicklung und Vermarktung Meilensteine erreicht werden, erhalten bis, und ist berechtigt, für bis zweistelligen Prozentbereich. Asahi Kasei Pharma wird exklusive Rechte zur Entwicklung und Vermarktung von Produkten in Japan, Korea, Taiwan und China für Schmerzen, Entzündungen und andere Nicht-Krebs-Indikationen.
"Wir freuen uns über die Partnerschaft unsere TrkA für Entzündung / Schmerzprogramm mit Asahi Kasei Pharma", sagte Ron Squarer, Chief Executive Officer, Array BioPharma. "Asahi Kasei Pharma ist das Programm in die klinische Entwicklung voranzubringen, die ihren potenziellen zukünftigen Wert freischalten."
Asahi Kasei Pharma verfügt über umfangreiche klinische Entwicklung Erfahrung in der Schmerzbereich, insbesondere im Bereich der Muskel-Skelett-Schmerzen. Asahi Kasei Pharma fördert Elcitonin ™ für Schmerzen im Zusammenhang mit Osteoporose und war zuvor in die Co-Promotion das entzündungshemmende Medikament Voltaren® mit Novartis in Japan beteiligt. Asahi Kasei Pharma ist stark für die Entwicklung und Verbindungen in der chronischen Schmerzfeld als nächstes wichtigen therapeutischen Bereich kommerzialisieren.
Über Asahi Kasei Pharma
Asahi Kasei Pharma Corporation mit Sitz in Tokio, Japan, ist ein Forschungs-basierten Gesundheitsversorgung Innovator, entdeckt, entwickelt, produziert und vermarktet Arzneimittel und diagnostische Produkte. Asahi Kasei Pharma ist eine hundertprozentige Tochter der Asahi Kasei Corporation, ein 18 Mrd. US- $ Technologie-Unternehmen, das innovative bietet, wissenschaftlich fundierte Lösungen für ein breites Spektrum von Märkten, einschließlich Gesundheitswesen, Chemikalien und Fasern, Gehäuse und Baumaterialien und Elektronik. Weitere Informationen finden Sie in der Asahi Kasei Corporation Website besuchen www.asahi-kasei.co.jp .
Über Array BioPharma
Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Kommerzialisierung von gezielten, niedermolekulare Medikamente Patienten mit Krebs leidet, zu behandeln. Sechs Zulassungsstudien sind avanciert gegenwärtig im Zusammenhang mit drei Krebsmedikamente. Zu diesen Programmen gehören binimetinib (MEK162), encorafenib (LGX818) und selumetinib (Astrazeneca). Für weitere Informationen über Array, gehen Sie bitte auf www.arraybiopharma.com .
Array BioPharma vorausschauende Aussage
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen im Sinne des Private Securities Litigation Reform Act von 1995, einschließlich Aussagen über die klinischen Entwicklungspläne für das Programm TrkA-Inhibitor Asahi Kasei Pharma lizenziert, Erwartungen, Ereignisse, die auftreten wird in größerem Wert führt das Potenzial für die Ergebnisse der laufenden präklinischen Studien für das Programm zu Asahi Kasei Pharma lizenziert oder für Array, die weitere Entwicklung und die Zulassung oder den Markterfolg eines Wirkstoffkandidaten, und die Fähigkeit von Asahi Kasei Pharma unterstützen die Meilensteine zu erreichen, was zu Zahlungen an uns im Rahmen der Vereinbarung. Diese Aussagen beinhalten erhebliche Risiken und Unsicherheiten, einschließlich der in unserem jüngsten Jahresbericht auf Formblatt 10-K, in unseren Quartalsberichten eingereicht auf Formular 10-Q und in anderen Berichten von Array bei der Securities and Exchange Commission. Da diese Aussagen unsere gegenwärtigen Erwartungen bezüglich zukünftiger Ereignisse widerspiegeln, könnten unsere tatsächlichen Ergebnisse wesentlich von denen abweichen, die in diesen zukunftsgerichteten Aussagen als Ergebnis vieler Faktoren erwartet. Diese Faktoren umfassen, sind aber nicht beschränkt auf, Risiken im Zusammenhang mit unserer Abhängigkeit von unseren Mitarbeitern für die klinische Entwicklung und Kommerzialisierung unserer auslizenziert Wirkstoffkandidaten; die Fähigkeit unserer Mitarbeiter und der Array Ziele Meilensteine und Lizenzgebühren gebunden zu erfüllen; die Fähigkeit, effektiv und rechtzeitig Verhalten klinischen Studien im Hinblick auf Kosten und Schwierigkeiten bei der Suche nach geeigneten Prüfzentren und bei der Aufnahme von Patienten zu erhöhen, die die Kriterien für bestimmte klinische Studien erfüllen; und Risiken im Zusammenhang mit Abhängigkeit auf fremden Dienstleistern erfolgreich führen klinische Studien innerhalb und außerhalb der Vereinigten Staaten. Wir stellen diese Informationen zum 31. März 2016. Wir übernehmen keine Verpflichtung übernehmen, irgendwelche zukunftsgerichteten Aussagen zu aktualisieren, um das Auftreten von Ereignissen oder Umständen nach dem Datum dieser Aussagen oder erwarteter oder unerwarteter Ereignisse zu berücksichtigen, dass alle zugrunde liegenden Annahmen, solche Aussagen zu ändern .
KONTAKT:
§
Tricia Haugeto
(303) 386-1193
thaugeto@arraybiopharma.com
Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Kommerzialisierung von gezielten, niedermolekulare Medikamente Patienten mit Krebs leidet, zu behandeln. Sechs Phase-3-Studien sind avanciert gegenwärtig. Diese Programme umfassen drei Krebsmedikamente , binimetinib (MEK162), encorafenib (LGX818) und selumetinib (in Partnerschaft mit Astrazeneca ).
15.05 01.04.16
http://www.ariva.de/news/...inue-MILO-Study-In-Ovarian-Cancer-5701234
BOULDER, Colo, 1. April 2016 / PRNewswire / - Array BioPharma Inc. (Nasdaq: ARRY). Gab heute seine Entscheidung , die MILO - Studie, einer Phase - 3 - Studie von binimetinib für die Behandlung von Patienten mit low-grade seröse ovarian einzustellen Krebs. Die Entscheidung, die Studie zu stoppen, wurde gemacht, nachdem eine geplante Zwischenanalyse zeigte, dass die Hazard Ratio für progressionsfreies Überleben (PFS), die vordefinierten Sinnlosigkeit Grenze überschritten. Top-Line-Ergebnisse aus der Studie war im Jahr 2017 erwartet.
PR Newswire über CMTX - Tue Apr 26, 11.25 CDT
http://www.barchart.com/headlines/story/1439140/...2016-on-may-3-2016
Array BioPharma Inc. (Nasdaq: ARRY) wird die Finanzergebnisse für das dritte Quartal des Geschäftsjahres 2016 berichten und eine Telefonkonferenz abhalten , um diese Ergebnisse am Dienstag, den 3. Mai 2016. Ron Squarer, Chief Executive Officer, zu diskutieren , wird das Gespräch führen.
http://photos.prnewswire.com/prnvar/20121029/LA02195LOGO
Date: Tuesday, May 3, 2016
Time: 9:00 a.m. Eastern Time
Toll-Free: (844) 464-3927
Toll: (765) 507-2598
Pass Code: 86078064
Webcast, including Replay and Conference Call Slides:
http://edge.media-server.com/m/p/stxvbem8
Über Array BioPharma Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung von zielgerichteten Medikamenten kleines Molekül Patienten mit Krebs leidet, zu behandeln. Fünf Zulassungsstudien sind avanciert gegenwärtig im Zusammenhang mit drei Krebsmedikamente. Zu diesen Programmen gehören binimetinib (MEK162), encorafenib (LGX818) und selumetinib (Astrazeneca). Für weitere Informationen über Array, gehen Sie bitte auf www.arraybiopharma.com.
KONTAKT: Tricia Haugeto
Array BioPharma Inc.
(303) 386-1193
thaugeto@arraybiopharma.com
Veröffentlicht am 23, April 2016 von Stefani Robinson in Consensus Rating Artikel , Investitionen
http://sleekmoney.com/...nsensus-rating-of-buy-by-brokerages/1128917/
Array Biopharma Inc (NASDAQ: ARRY) hat eine durchschnittliche Bewertung von "Buy" durch die sechs brokerages gegeben worden , die derzeit decken die Firma, Analyst Bewertungen Network.com berichtet . Ein Analyst hat die Aktie mit einem Sell Rating bewertet hat ein zugewiesen ein Rating halten und vier haben eine Kaufempfehlung für das Unternehmen zugeordnet. Die durchschnittliche 1-Jahres-Kursziel unter Broker, die einen Bericht über die Aktie im vergangenen Jahr ausgegeben haben, ist 6,50 $.
Mehrere Aktien-Analysten auf ARRY Aktien vor kurzem kommentiert. Cantor Fitzgerald neu aufgelegt ein Rating "buy" auf Aktien von Array Biopharma in einem Bericht über Dienstag, 2. Februar. Stifel Nicolaus ihr Kursziel geschnitten auf Aktien von Array Biopharma von $ 8,00 bis $ 7,00 und setzen ein Rating "buy" für das Unternehmen in einem Bericht über Mittwoch, 3. Februar. Zacks Investment Research erhöht Aktien von Array Biopharma von einem "hold" -Rating ein Rating "buy" und legen Sie einen $ 4,75 Kursziel für das Unternehmen in einem Bericht über Dienstag, 5. Januar. Schließlich neu aufgelegt Piper Jaffray ein Rating "buy" auf Aktien von Array Biopharma in einem Bericht über Samstag, 2. April.
Ein Hedge-Fonds kaufte vor kurzem eine neue Beteiligung an der Array Biopharma Lager. ClariVest Asset Management LLC einen neuen Beteiligung in Array Biopharma Inc gekauft (NASDAQ: ARRY) im vierten Quartal, Holdings Channel - Berichte. Der Fonds kaufte 178.748 Aktien der Aktien des Biopharma-Unternehmen, bei etwa 753.000 $ geschätzt. ClariVest Asset Management LLC besaß 0,13% Array Biopharma als seiner jüngsten Einreichung bei der SEC.
Array Biopharma ( NASDAQ: ARRY ) eröffnet bei 3,25 am Montag. Array Biopharma verfügt über eine 52-Wochen-Tief von 2,38 $ und ein 52-Wochen-Hoch von $ 8,04. Die Aktie hat eine Marktkapitalisierung von $ 465.850.000 und einen PE-Verhältnis von 3250,00. Die Firma verfügt über eine 50-Tage-Durchschnitt von 2,97 $ und einem 200-Tage-Durchschnitt von 3,69 $.
Array Biopharma (NASDAQ: ARRY) haben zuletzt das Quartalsergebnis Ergebnisse am Dienstag 2. Februar. Das biopharmazeutische Unternehmen berichtet ($ 0,17) EPS für das Quartal, die Konsensschätzung von ($ 0,06) von 0,11 $ fehlt. Während des gleichen Zeitraums im Vorjahr erzielte die Firma ($ 0,06) Ergebnis je Aktie. Das Unternehmen hatte einen Umsatz von $ 35,40 Millionen für das Quartal im Vergleich zum Konsensschätzung von $ 32,70 Millionen. Das Geschäftsmodell des Quartalsumsatz stieg um 31,7% im Vergleich zum gleichen Quartal des Vorjahres. Aktien-Analysten gehen davon aus, dass die Array Biopharma wird Post ($ 0,58) Ergebnis je Aktie für das laufende Geschäftsjahr.
Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung von niedermolekularen Wirkstoffen Patienten mit Krebs leidet, zu behandeln. Die vollständig der Gesellschaft im Besitz der klinischen Phase Medikamente sind Filanesib in Phase II der klinischen Studien wird für Kinesin - Spindel - Protein angegeben ( NASDAQ: ARRY ), Inhibitor für MM; ARRY-797 in Phase II der klinischen Studien zeigten für p38-Inhibitor für Lamin A / C-bezogene dilatative Kardiomyopathie (LMNA-DCM); ARRY-502 in Phase II der klinischen Studien zeigten für CRTh2-Antagonisten zur Behandlung von Asthma und ARRY-614 in Phase I der klinischen Studien wird für p38 / Tie2 dualer Inhibitor für myelodysplastischen Syndromen angezeigt (MDS).
12 Month Chart for NASDAQ:ARRY
14.05 03.05.16
PR Newswire
http://www.ariva.de/news/...-The-Third-Quarter-Of-Fiscal-2016-5737477
BOULDER, Colo., 3. Mai 2016
BOULDER, Colo, 3. Mai 2016 / PRNewswire / - Array BioPharma Inc.. (NASDAQ: ARRY), ein biopharmazeutisches Unternehmen , sich auf die Entdeckung, Entwicklung und Kommerzialisierung von gezielten kleinen Molekül Krebstherapien, berichtet heute die Ergebnisse für das Geschäftsjahr dritten endende Quartal 31. März 2016 und ein Update über den Fortschritt der wichtigsten klinischen Entwicklungsprogramme.
Array BioPharma.
"Wir haben eine Reihe von kurzfristigen Werttreiber, die von unserer geplanten NDA-Antrag für binimetinib hervorgehoben basiert auf den Ergebnissen unserer Phase-3-Studie in NRB-Mutante Melanompatienten (NEMO)", sagte Ron Squarer, Array Chief Executive Officer. "Bei ASCO werden wir die vollständigen Ergebnisse aus der NEMO-Studie präsentieren, sowie ein Update auf unserer Phase-2-Studie von encorafenib und Cetuximab bei Patienten BRAF-mutiertem Darmkrebs bieten. Später in diesem Sommer planen wir von Top-Line-Ergebnisse zu teilen COLUMBUS, unsere Phase-3-Studie von binimetinib und encorafenib in BRAF Melanom-Patienten. Wir erwarten, dass auch die Ergebnisse von SELECT-1, eine Studie von selumetinib in zweiter Linie K-ras-mutierten nicht-kleinzelligem Patienten kleinzelligem Lungenkrebs. in Anbetracht unserer geschätzten Cash-Landebahn, eine Reihe starker Partnerschaften und setzte Novartis Finanzierung laufender binimetinib und encorafenib Studien sind wir gut positioniert, um unsere langfristige Strategie umzusetzen. "
KEY PIPELINE UPDATES
Binimetinib (MEK162) und encorafenib (LGX818)
Novartis - Abkommen
Novartis weiter zu führen und / oder im Wesentlichen alle laufenden Studien mit binimetinib und encorafenib durch ihre Vollendung zu finanzieren, einschließlich der NEMO und COLUMBUS Studien. Die Erstattung Einnahmen von Novartis betrug ca. 74.000.000 $ für die letzten 9 Monate, davon 64 Mio. $ wurde in den letzten beiden Quartalen.
NEMO: Globale Phase - 3 - Studie von binimetinib gegen Dacarbazin in NRB-Mutante Melanompatienten
Basierend auf den Ergebnissen des NEMO-Studie, Array plant eine NDA in der ersten Hälfte von 2016. Die Ergebnisse von NEMO vorlegen wird auf der 2016 American Society of Clinical Oncology Konferenz (ASCO) präsentiert werden und wird das progressionsfreie Überleben (PFS) umfassen , das Gesamtüberleben (OS), die objektive Ansprechrate (ORR), Sicherheit und im Voraus festgelegten Untergruppen-Analysen, einschließlich der Ergebnisse bei Patienten, die vor der Behandlung mit Immuntherapie erhalten.
Die Aktivierung NRB Mutationen sind in etwa 20% der Patienten mit metastasierendem Melanom, und hat eine schlechte prognostischer Indikator für diese Patienten gewesen. Die Behandlungsmöglichkeiten für diese Population bleiben über Immuntherapie (PD-1, CTLA4) begrenzt, daher könnte binimetinib eine wichtige zusätzliche Therapie für diese Patienten darstellen.
COLUMBUS: Globale Phase - 3 - Studie von binimetinib Plus encorafenib gegen Vemurafenib in BRAF-mutierten Melanompatienten
Im Rahmen des Standard-Datenreinigungsprotokoll Array, wurde es vor kurzem erfahren, dass weitere PFS Ereignisse vor der Datenbanksperre und abschließenden Analyse beobachtet werden müssen, ein Prozess zuvor bis Ende Juni abgeschlossen sein. Array jetzt Projekte COLUMBUS Top-Line-Ergebnisse Verfügbarkeit im dritten Quartal 2016.
Die Aktivierung BRAF-Mutationen sind in etwa 50% der Patienten mit metastasierendem Melanom vorhanden. In zwei separaten Phase 1/2 Studien in dieser Patientenpopulation, binimetinib und encorafenib zeigte ermutigende klinische Aktivität und ein attraktives Verträglichkeitsprofil, einschließlich niedrige Inzidenz von Pyrexie, und wenig bis gar keine Inzidenz von Hautausschlag oder Lichtempfindlichkeit. Die Patienten in zwei Phase-3-Studien mit Dabrafenib behandelt und trametinib (COMBI-d und COMBI-v) erlebte mehr als 50% Inzidenz von Pyrexie (Fieber), während in einem großen, randomisierten Studie von Vemurafenib und cobimetinib (coBRIM) fast 50% der Patienten erfahren Lichtempfindlichkeitsreaktionen. Von den Patienten, die Pyrexie auf COMBI-d und COMBI-v, auf die Hälfte ein Drittel berichtet, drei oder mehr Ereignisse erlebt, und mindestens die Hälfte erforderliche Dosis Modifikationen einschließlich Unterbrechungen, Reduktionen, oder das Absetzen infolge ihrer Pyrexie. Von den Patienten, die Lichtempfindlichkeit auf coBRIM erlebt, war die mediane Dauer der Lichtempfindlichkeit von drei Monaten Dauer als 14 Monate für einige Patienten so lange war. Nur 63% der Patienten mit Lichtempfindlichkeitsreaktionen erlebt Auflösung während Studie.
BRAF-mutiertem Darmkrebs
Array aktualisierten Ergebnisse, einschließlich PFS und OS, aus der Phase 2-Kombinationsstudie mit encorafenib bei Patienten mit BRAF-mutiertem Darmkrebs (BRAF CRC) wird auf der ASCO 2016. auf die Stärke der bestehenden Phase Basierend präsentiert zwei Kombinationsdaten, Array Pläne eine Phase-3-globale Zulassungsstudie bei dieser Patientenpopulation initiieren später in diesem Jahr.
Darmkrebs ist die dritthäufigste Krebserkrankung bei Männern und Frauen in den Vereinigten Staaten, mit rund 134.000 neue Fälle und fast 50.000 Todesfälle durch die im Jahr 2016 BRAF - Mutationen projizierten Krankheit treten bei bis zu 20% Prozent der Patienten mit kolorektalem Karzinom und stellt ein schlechte Prognose für diese Patienten. Historische veröffentlicht PFS und OS Ergebnisse nach der ersten Zeile Bereich von 1,8 bis 2,5 Monate und 4,7 bis 5,9 Monate. Darüber hinaus historische veröffentlichte Ansprechraten aus verschiedenen Studien für EGFR-Therapie in dieser Population Bereich von 6% bis 8%. Array der Daten an der 2015 European Society of Medical Oncology des World Congress of Gastrointestinal Cancer (ESMO GI) vergleichen geteilt sowohl positiv auf die derzeit verfügbaren Therapien für BRAF CRC-Patienten und anderen kürzlich veröffentlichten Untersuchungsansätze in dieser Population. Die Kombination aus encorafenib und Cetuximab hat mit den meisten behandlungsbezogenen unerwünschten Ereignisse sind Grad 1 oder 2 und wenige Grad 3 oder 4 unerwünschten Ereignisse ein gut verträgliches Sicherheitsprofil gezeigt.
ARRY-797 (ARRY-371797)
Phase 2 - Studie im Gange bei Patienten mit LMNA A / C-bezogene dilatative Kardiomyopathie (DCM)
Array ist die Durchführung einer 12-Patienten Phase-2-Studie zur Untersuchung der Wirksamkeit und Sicherheit von ARRY-797 bei Patienten mit LMNA A / C-bezogene DCM, einer schweren, genetische Herz-Kreislauf- Erkrankungen zu bewerten. Die Ergebnisse werden auf der European Society of Cardiology am 30. August vorgestellt 2016. Im Alter von 45, ca. 70% der Patienten mit LMNA A / C-bezogene DCM gestorben, ein großes kardiales Ereignis erlitten hat , oder eine Herztransplantation unterzogen wurden . Die Daten über den primären Endpunkt der mittleren Änderung der Sechs-Minuten-Gehtest (6MWT) nach 12 Wochen gegenüber Baseline überschreitet durch eine Reihe von Medikamenten für seltene Krankheiten setzen Maßstäbe vor kurzem genehmigt auf der Grundlage des 6MWT als primären Endpunkt. Die sekundären Endpunkte in der ARRY-797-Studie, einschließlich Änderungen der N-terminalen Pro-brain-derived natriuretischen Peptid (NT-proBNP, einem Serum-Biomarker von Herzinsuffizienz Schweregrad) und der Patienten-Ergebnisse berichtet, sind richtungs im Einklang mit dem primären Endpunkt. Daten für Patienten folgten über 48 Wochen eine dauerhafte Wirkung vor. Zusammengenommen deuten die Daten bisher einen Weg nach vorn für dieses Programm und Array hat mit den Aufsichtsbehörden erfüllt das Design einer Studie zu diskutieren, die die Grundlage für die Marktzulassung sein könnte.
Selumetinib ( in Partnerschaft mit Astrazeneca)
Zulassungsstudien in NSCLC vorrückenden (SELECT-1), Schilddrüsenkrebs (ASTRA) und Neurofibromatose Typ 1
Zeneca weiterhin selumetinib in drei Zulassungsstudien voraus: SELECT-1 bei Patienten mit KRAS-mutierten nicht-kleinzelligem Lungenkrebs (NSCLC), eine Zulassungsstudie bei Patienten mit Neurofibromatose Typ 1 und ASTRA bei Patienten mit differenzierten Schilddrüsenkrebs. Zeneca erwartet Top-Line-Ergebnisse aus SELECT-1 in der zweiten Hälfte des Jahres 2016 und zeigt ein Zulassungsantrag von selumetinib in NSCLC in der ersten Hälfte 2017.
SELECT-1 ist ein 500-Patienten randomisierte, doppelblinde, Placebo-kontrollierte Studie, die die Sicherheit und Wirksamkeit von selumetinib plus Docetaxel als Zweitlinientherapie zu bewerten in lokal fortgeschrittenem oder metastasiertem KRAS-mutierten NSCLC entwickelt wurde. KRAS-Mutationen gehören zu den häufigsten Mutationen in NSCLC, die in etwa einem Viertel dieser Patienten. Ziel der Studie ist PFS als primärer Endpunkt zu bewerten und ein wichtiger sekundärer Endpunkt ist OS. Zeneca Entscheidung selumetinib Fortschritte 3 in NSCLC zu Phase folgte die Ergebnisse aus einer randomisierten Phase-2-Studie, die die Kombination von selumetinib mit Docetaxel gegen Docetaxel allein in KRAS-Mutation positiven NSCLC zu bewerten. Diese Studie zeigte Ansprechraten von 37,2% vs 0% (p <0,0001) und eine statistisch signifikante Verbesserung des PFS von 5,3 vs 2,1 Monate (HR 0,58, p <0,014).
ARRY-954 / Select Tropomyosin - Rezeptorkinase A (TrkA) -Inhibitor für Schmerzen und Entzündungen
Strategische Zusammenarbeit mit Asahi Kasei Pharma Corporation Asia-Focused; Array behält sich das Recht für alle Verbindungen für alle Indikationen außerhalb Asiens
Im März 2016 kündigte Array eine strategische Zusammenarbeit mit Asahi Kasei Pharma Corporation wählen präklinischen TrkA - Inhibitoren zur Entwicklung und Vermarktung, einschließlich Array-erfunden ARRY-954, für Schmerzen, Entzündungen und andere Nicht-Krebs - Indikationen. Gemäß den Bedingungen der Vereinbarung, Array behält sich das Recht für alle Verbindungen für alle Indikationen außerhalb Asiens. Innerhalb Asiens Array behält sich das Recht auf Krebsindikationen für alle Verbindungen, mit Ausnahme derjenigen Verbindungen , die durch Asahi Kasei Pharma entwickelt, einschließlich ARRY-954. Asahi Kasei Pharma wird exklusive Rechte zur Entwicklung und Vermarktung von Produkten in Japan, Korea, Taiwan und China für Schmerzen, Entzündungen und andere Nicht-Krebs - Indikationen. Array erhielt eine Vorauszahlung in Höhe von $ 12.000.000, das Recht auf 64.000.000 $ erhalten, wenn bestimmte Entwicklung und Vermarktung Meilensteine erreicht werden, und ist berechtigt , bis zu zweistellige Lizenzgebühren. Die Aktivierung des TrkA Weg von Nervenwachstumsfaktor (NGF) wurde in der Pathogenese vieler schwieriger zu behandeln menschlichen Schmerzzuständen wie Arthrose Schmerzen, chronischen Rückenschmerzen, diabetische periphere Neuropathie, Krebsschmerzen und interstitielle Zystitis verwickelt.
KENNZAHLEN
Liquide Mittel, Wertpapiere betrugen etwa 118 Millionen $ und Forderungen betrug ca. 63.000.000 $ am Ende des Quartals. Die Forderungen bestehen im Wesentlichen aus Forderungen voraussichtlich innerhalb von drei Monaten von Novartis bezahlt werden und den $ 12,0 Mio. up-front Gebühr von Asahi Kasei Pharma, die im April 2016 aufgenommen wurde. Im März 2015 binimetinib und encorafenib wurde hundertprozentige Vermögen von Array, die aufgefordert, Änderungen an der Einstufung der Einnahmen und Ausgaben für die Programme. Die neuen Kosten Einstufungen wurden im vierten Quartal des Geschäftsjahres 2015 Finanzergebnis enthalten. Ab dem ersten Quartal des Geschäftsjahres 2016, Array mit Umsatz von Novartis Erstattungen im Rahmen ihrer Vereinbarungen mit Novartis für binimetinib und encorfenib als separate Position als "Erstattung Einnahmen." Das Nettoergebnis (oder Verlust) je Aktie weiter unten beschrieben sind verwässerte Ergebnis (oder Verlust) je Aktie.
Dritte Quartal des Geschaftsjahres 2016 im Vergleich zum zweiten Quartal des Geschäftsjahres 2016 (Sequential Quarters Vergleich)
Der Umsatz für das dritte Quartal des Geschäftsjahres 2016 betrug $ 43,0 Mio., im Vergleich zu $ 35.400.000 für den Stand der Folgequartalen. Die $ 7.600.000 Umsatzsteigerung ist vor allem auf höhere Erstattungs Umsatz von Novartis. Kosten Partner - Programme für das dritte Quartal des Geschäftsjahres 2016 betrug $ 5,8 Mio. im Vergleich zu $ 5.700.000 für das Vorquartal. Die Forschungs- und Entwicklungsaufwand wurde 48.800.000 $, im Vergleich zu 41.400.000 $ im Vorquartal. Der Anstieg der Forschungs- und Entwicklungsaufwand wird auf den laufenden Übergang von binimetinib und encorafenib Studien von Novartis zu Array. Der Nettoverlust für das dritte Quartal in erster Linie im Zusammenhang war $ 22.700.000 oder ($ 0,16) je Aktie und war $ 24.200.000 oder ($ 0,17) pro Aktie im Vorquartal.
Dritte Quartal des Geschaftsjahres 2016 im Vergleich zum dritten Quartal des Geschäftsjahres 2015 (Vorjahr zum Vergleich)
Im Vergleich zum gleichen Quartal des Geschäftsjahres 2015 stieg der Umsatz im dritten Quartal des Geschäftsjahres 2016 erhöhte sich um $ 36.400.000, vor allem auf $ 36.900.000 in der Erstattung Einnahmen von Novartis. Kosten Partnerprogramme verringerten sich um $ 6.300.000 im Vergleich zum dritten Quartal des Geschäftsjahres 2015 in erster Linie aufgrund binimetinib Entwicklungskosten werden auf immer hundertprozentige Programme als Forschungs- und Entwicklungsaufwand anstelle von Kosten für Partnerprogramme vorgestellt. Forschungs- und Entwicklungskosten Mio. um 37,0 $ stieg im Vergleich zum dritten Quartal des Geschäftsjahres 2015 aufgrund der Kategorisierung von binimetinib Kosten, wie auch neue Ausgaben für encorafenib. der Nettoverlust für das dritte Quartal des Geschäftsjahres 2016 betrug $ 22.700.000 oder ($ 0,16) je Aktie und lag der Nettogewinn von $ 58.300.000 oder $ 0,37 Nettogewinn pro Aktie im gleichen Quartal im Geschäftsjahr 2015.
Neun Monate des Geschäfts 2016 Im Vergleich zu der ersten neun Monate des Geschäftsjahres 2015 (Vorjahr zum Vergleich)
Für die neun Monate bis zum 31. März 2016 betrug der Umsatz $ 94.700.000 im Vergleich zu $ 39.600.000 für den gleichen Zeitraum im Geschäftsjahr 2015. Der Nettoverlust für die ersten neun Monate zum 31. März 2016 betrug $ 67.800.000 oder ($ 0,47) je Aktie, im Vergleich zu einem Nettogewinn von $ 22.100.000 oder $ 0,16 je Aktie im Vorjahreszeitraum. Das dritte Quartal des Geschäftsjahres 2015 enthalten eine einmalige $ 80,0 Mio. Nettogewinn aus den binimetinib und encorafenib Vereinbarungen. Der Mittelabfluss für die neun Monate zum 31. März 2016 betrug 62 Millionen US $.
Informationen zur Telefonkonferenz
Array wird eine Telefonkonferenz am Dienstag, den 3. Mai 2016 um 9:00 Uhr Eastern Time halten diese Ergebnisse zu diskutieren. Ron Squarer, Chief Executive Officer, wird das Gespräch führen.
Datum:
§
Dienstag, 3. Mai 2016
Zeit:
§
09.00 Eastern Time
Zollfrei:
§
(844) 464-3927
Maut:
§
(765) 507-2598
Pass - Code:
86078064
§
Webcast, einschließlich Replay und Telefonkonferenz Folien:
http://edge.media-server.com/m/p/stxvbem8
Über Array BioPharma
Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Kommerzialisierung von gezielten, niedermolekulare Medikamente Patienten mit Krebs leidet, zu behandeln. Fünf Zulassungsstudien sind avanciert gegenwärtig im Zusammenhang mit drei Krebsmedikamente. Zu diesen Programmen gehören binimetinib (MEK162), encorafenib (LGX818) und selumetinib (Astrazeneca). Für weitere Informationen über Array, gehen Sie bitte auf www.arraybiopharma.com .
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen im Sinne des Private Securities Litigation Reform Act von 1995, einschließlich Aussagen über den Zeitpunkt der Bekanntgabe der Ergebnisse von klinischen Studien für unsere eigenen und unserer Partner-Programme, den Zeitpunkt der Fertigstellung oder die Einleitung das Potenzial für die Ergebnisse der laufenden präklinischen und klinischen Studien der Weiterentwicklung unserer hundertprozentige und unsere Partner-Programme, einschließlich der Zeitpunkt der regulatorischen Filings, Erwartungen, Ereignisse eintreten werden, dass in größeren Wert für Array führen wird, die Zulassung zu unterstützen oder der Markterfolg eines Wirkstoffkandidaten, unsere Fähigkeit, unsere proprietäre Wirkstoffkandidaten für die up-front Gebühren Partner, Meilenstein und / oder Lizenzzahlungen, unsere Pläne für die Zukunft unserer proprietären Programme und die Pläne unserer Mitarbeiter, um die Fortschritte und entwickeln Programme, um die Fortschritte und entwickeln wir müssen sie zugelassen und unsere Pläne für eine Spätstadium der Entwicklung Unternehmen zu bauen. Diese Aussagen beinhalten erhebliche Risiken und Unsicherheiten, einschließlich der in unserem jüngsten Jahresbericht auf Formblatt 10-K, in unseren Quartalsberichten eingereicht auf Formular 10-Q und in anderen Berichten von Array bei der Securities and Exchange Commission. Da diese Aussagen unsere gegenwärtigen Erwartungen bezüglich zukünftiger Ereignisse widerspiegeln, könnten unsere tatsächlichen Ergebnisse wesentlich von denen abweichen, die in diesen zukunftsgerichteten Aussagen als Ergebnis vieler Faktoren erwartet. Diese Faktoren umfassen, sind aber nicht beschränkt auf, unsere Fähigkeit zur Finanzierung fortzusetzen und erfolgreich interne Forschungs- und Entwicklungsbemühungen Fortschritte und effektiv, wirtschaftlich tragfähige Drogen zu schaffen; Risiken im Zusammenhang mit unserer Abhängigkeit von unseren Mitarbeitern für die klinische Entwicklung und Kommerzialisierung unserer auslizenziert Wirkstoffkandidaten; die Fähigkeit unserer Mitarbeiter und der Array Ziele Meilensteine und Lizenzgebühren gebunden zu erfüllen; unsere Fähigkeit, effektiv und rechtzeitig Verhalten klinischen Studien im Hinblick auf Kosten und Schwierigkeiten bei der Suche nach geeigneten Prüfzentren und bei der Aufnahme von Patienten zu erhöhen, die die Kriterien für bestimmte klinische Studien erfüllen; Risiken im Zusammenhang mit unserer Abhängigkeit von Drittanbieter - Dienstleister erfolgreich klinischen Studien innerhalb und außerhalb der Vereinigten Staaten durchzuführen; unsere Fähigkeit, die Profitabilität zu erreichen und zu halten und ausreichend flüssige Mittel zu erhalten; das Ausmaß, in dem die pharmazeutische und biotechnologische Industrie bereit, in Lizenz-Medikamentenkandidaten für ihre Produkt-Pipelines und mit der Zusammenarbeit und Dritten auf ihren Wirkstoffforschungsaktivitäten finanzieren; unsere Fähigkeit zur Auslizenzierung unserer eigenen Kandidaten zu günstigen Bedingungen; und unsere Fähigkeit zu gewinnen und zu erfahrenen Wissenschaftlern und Management behalten. Wir stellen diese Informationen ab 3. Mai 2016. Wir übernehmen keine Verpflichtung übernehmen , irgendwelche zukunftsgerichteten Aussagen zu aktualisieren , um das Auftreten von Ereignissen oder Umständen nach dem Datum dieser Aussagen oder erwarteter oder unerwarteter Ereignisse zu berücksichtigen , dass alle zugrunde liegenden Annahmen , solche Aussagen zu ändern .
ASCO Abstracts Veröffentlicht Heute Einschließlich # 9500 und # 3544
PR Newswire Array BioPharma
vor 21 Minuten
http://finance.yahoo.com/news/...ma-announces-key-data-210500027.html
BOULDER, Colo, 18. Mai 2016 / PRNewswire / -. Array BioPharma ( ARRY ) werden zusätzliche Daten , die auf seiner späten Phase - Kandidaten binimetinib und encorafenib in NRB -Mutante Melanom und -Mutante Darmkrebs BRAF, die jeweils an den 2016 amerikanischen Society of Clinical Oncology (ASCO) in Chicago, Illinois am 03-07 Juni.
Bild ansehen
.
Array BioPharma.
"Wir freuen uns Daten auf der ASCO aus unserem zentralen NEMO - Studie von binimetinib in NRB -Mutante Melanom zu präsentieren, die ihren primären Endpunkt des progressionsfreien Überlebens (PFS) erfüllt, und planen Sie eine New Drug Application (NDA) für binimetinib nächsten Monat einreichen ", sagte Ron Squarer, Chief Executive Officer von Array BioPharma. "Wichtig ist, dass in dem vorgegebenen Untergruppe von Patienten, die vor der Behandlung mit Immuntherapie, darunter Ipilimumab und nivolumab erhielten, betrug das mediane PFS 5,5 Monate für mit binimetinib Vergleich zu 1,6 Monaten bei Patienten, die mit Dacarbazin behandelt wurden. Diese Ergebnisse sind ermutigend die begrenzte Behandlungsmöglichkeiten zur Verfügung , um Patienten mit NRB -Mutante Melanom über die Immuntherapie. "
"Wir sind auch erfreut , die Ergebnisse aus unserer Phase - 2 - Studie von encorafenib und Cetuximab enthaltenden Regimen in BRAF -Mutante Darmkrebspatienten zu teilen , die nach einer oder mehreren früheren Therapien fortgeschritten sind" , fügte Herr Squarer. "Die Daten aus dieser Studie legen nahe, dass das mediane Gesamtüberleben (OS) für diese Patienten ein Jahr betragen kann, die wesentlich ist, wenn für diese Population zu historischen veröffentlichten Benchmarks verglichen, die zwischen vier bis sechs Monate reichen. Wir erwarten, dass dies zu präsentieren aktualisierte OS-Daten aus Studie auf dem ASCO und planen eine globale Phase - 3 - Studie in BRAF -Mutante Darmkrebs noch in diesem Jahr zu beginnen. "
BINIMETINIB
In der Phase - 3 - NEMO (N RAS M E LANOMA UND M EK INHBIT O R) Studie, 402 Patienten mit den NRB -Mutante Melanom wurden 2: 1 randomisiert binimetinib oder Dacarbazin, bzw. zu empfangen. Achtzig der 402 Patienten erhielten vor der Behandlung mit Immuntherapie.
Der primäre Endpunkt der PFS wurde erfüllt, mit einer Hazard-Ratio von 0,62 [95% CI von 0,47 bis 0,80] und einem p-Wert von weniger als 0,001. Die mediane PFS auf dem binimetinib Arm betrug 2,8 Monate versus 1,5 Monate auf dem Dacarbazin Arm.
Wichtig ist, dass eine Verbesserung der medianen PFS in binimetinib behandelten Patienten wurde in der vorgegebenen Untergruppe von Patienten, die vor der Behandlung mit Immuntherapie erhalten beobachtet. Die mediane PFS auf dem binimetinib Arm betrug 5,5 Monate gegenüber 1,6 Monate auf dem Dacarbazin Arm [HR = 0,46 (95% CI 0,26-0,81)].
Bestätigt Gesamtansprechrate (ORR) und Krankheitskontrollrate (DCR) waren 15 Prozent (95% CI, 11 bis 20 Prozent) und 58 Prozent (95% CI, 52-64 Prozent) für alle Patienten binimetinib empfangen jeweils im Vergleich zu 7 Prozent (95% CI, 3-13 Prozent) und 25 Prozent (95% CI, 18-33 Prozent) für Patienten Dacarbazin empfangen sind.
Grad 3/4 Nebenwirkungen (AEs) berichtet in mehr als oder gleich 5 Prozent der Patienten, die binimetinib enthalten Kreatinphosphokinase (CPK) und Bluthochdruck erhöht.
Array erwartet zusätzliche OS-Daten auf der ASCO vorzustellen.
Die Daten aus der Phase-3-Studie wird während einer mündlichen Präsentation am Montag, den 6. Juni 13.15 CT sehen sein:
Zusammenfassung 9500: Ergebnisse der NEMO: Eine Phase - III - Studie von binimetinib (BINI) vs Dacarbazin (DTIC) in NRB -Mutante Hautmelanom
Moderator: Reinhard Dummer, MD
ENCORAFENIB
In der Phase - 2 - BRAF -Mutante Darmkrebs - Studie wurden 102 Patienten randomisiert 1: 1 encorafenib und Cetuximab mit oder ohne alpelisib erhalten:
Median PFS war 5,4 Monate und 4,2 Monate für die Triplett und Dubletten Regimen sind.
Eine frühzeitige Analyse des medianen OS überschritten einem Jahr für die Triplett-Regime und wurde nicht für die Dublette Regime erreicht. Aktualisiert Zwischen mediane OS-Analyse für beide Therapien werden auf der ASCO vorgestellt.
Bestätigt ORR betrug 27 Prozent (95% CI, 16-41 Prozent) für die Triplett-Regime und 22 Prozent (95% CI, 12-36 Prozent) für die Dublette Regime.
Grad 3/4 auftretenden AEs in mehr als 10 Prozent der Patienten in beiden Armen enthalten Anämie, Hyperglykämie und erhöhte Lipase.
Historische veröffentlicht PFS und OS Ergebnisse nach Erstlinientherapie Bereich zwischen 1,8 bis 2,5 Monaten und vier bis sechs Monate, bzw., und veröffentlichte Ansprechraten aus verschiedenen Studien in dieser Population Bereich zwischen 6 bis 8 Prozent.
Die Daten der Phase-2-Studie wird am Samstag, 4. Juni präsentiert werden von 8.00 bis 11.30 Uhr CT:
Zusammenfassung 3544: Phase 2 Ergebnisse: encorafenib (ENCO) und Cetuximab (CETUX) mit oder ohne alpelisib (ALP) bei Patienten mit fortgeschrittenen BRAF -Mutante Kolorektalkarzinom (BRAF m CRC)
Moderator: Josep Tabernero, MD, Ph.D.
Zusätzliche Daten von Array BioPharma und Partner-Verbindungen werden auch in einer Vielzahl von Tumorarten auf der ASCO vorgestellt.
Alle Abstracts können über die ASCO - Website zugegriffen werden kann, http://abstract.asco.org/ . Nach den Präsentationen und Plakate öffentlich sind, werden sie als PDF - Dateien auf Array-Website unter verfügbar sein www.arraybiopharma.com .
Über NRB -Mutante Melanom
Aktivieren NRAS Mutationen sind in bis zu 20 Prozent der Patienten mit metastasierendem Melanom, und ist ein schlechtes prognostischer Indikator für diese Patienten. Die Behandlungsmöglichkeiten für diese Population bleiben über die Immuntherapie begrenzt, und die Patienten konfrontiert schlechte klinische Ergebnisse und eine hohe Sterblichkeit.
Über BRAF -Mutante Kolorektalkarzinom
Darmkrebs ist die dritthäufigste Krebserkrankung bei Männern und Frauen in den Vereinigten Staaten, mit mehr als 134.000 neue Fälle und fast 50.000 Todesfälle durch die im Jahr 2016 projiziert Krankheit.
Über Binimetinib und Encorafenib
MEK und BRAF sind wichtige Proteinkinasen in dem MAPK-Signalweg (RAS-RAF-MEK-ERK). Forschung hat gezeigt, dieser Weg mehrere wichtige Zellaktivitäten, einschließlich Proliferation, Differenzierung, Überleben und die Angiogenese reguliert. Unangemessenen Aktivierung von Proteinen in diesem Stoffwechselweg ist in vielen Krebsarten, wie Melanom, nicht-kleinzelligem Lungen-, Dickdarm- und Schilddrüsenkrebs auftreten gezeigt. Binimetinib ist ein Spätstadium kleines Molekül MEK-Inhibitor und encorafenib ist ein Spätstadium kleines Molekül BRAF-Hemmer, die beide in diesem Stoffwechselweg Schlüsselenzyme Ziel.
NRB -Mutante Melanom (NEMO, binimetinib Einzelmittel) und BRAF -Mutante Melanom in Kombination mit encorafenib (COLUMBUS, binimetinib und encorafenib): Binimetinib und encorafenib werden in Phase 3 - Studien in fortgeschrittenen Krebspatienten, einschließlich untersucht. Die Aktivierung BRAF sind Mutationen in etwa 50 Prozent der Patienten mit metastasierendem Melanom vorhanden. NRB -Mutante Melanom die erste mögliche Indikation für binimetinib darstellt, mit einer geplanten Zulassungsantrag geschätzt in der ersten Hälfte 2016. Array auch Projekte COLUMBUS Top-Line - Ergebnisse Verfügbarkeit während im dritten Quartal 2016. Darüber hinaus Array plant , eine Phase - 3 - globale Zulassungsstudie bei Patienten mit BRAF -Mutante Darmkrebs im Laufe dieses Jahres zu beginnen.
Über Array BioPharma
Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Kommerzialisierung von gezielten, niedermolekulare Medikamente Patienten mit Krebs leidet, zu behandeln. Fünf Zulassungsstudien sind avanciert gegenwärtig im Zusammenhang mit drei Krebsmedikamente. Zu diesen Programmen gehören binimetinib (MEK162), encorafenib (LGX818) und selumetinib (Astrazeneca). Für weitere Informationen über Array, gehen Sie bitte auf www.arraybiopharma.com .
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen im Sinne des Private Securities Litigation Reform Act von 1995, einschließlich Aussagen über den Zeitpunkt der Bekanntgabe der Ergebnisse von klinischen Studien für unsere eigenen und unserer Partner-Programme, den Zeitpunkt der Fertigstellung oder die Einleitung das Potenzial für die Ergebnisse der laufenden präklinischen und klinischen Studien der Weiterentwicklung unserer hundertprozentige und unsere Partner-Programme, einschließlich der Zeitpunkt der regulatorischen Filings, Erwartungen, Ereignisse eintreten werden, dass in größeren Wert für Array führen wird, die Zulassung zu unterstützen oder der Markterfolg eines Wirkstoffkandidaten, und unsere zukünftigen Pläne unserer eigenen Programme, um die Fortschritte und zu entwickeln. Diese Aussagen beinhalten erhebliche Risiken und Unsicherheiten, einschließlich der in unserem jüngsten Jahresbericht auf Formblatt 10-K, in unseren Quartalsberichten eingereicht auf Formular 10-Q und in anderen Berichten von Array bei der Securities and Exchange Commission. Da diese Aussagen unsere gegenwärtigen Erwartungen bezüglich zukünftiger Ereignisse widerspiegeln, könnten unsere tatsächlichen Ergebnisse wesentlich von denen abweichen, die in diesen zukunftsgerichteten Aussagen als Ergebnis vieler Faktoren erwartet. Diese Faktoren umfassen, sind aber nicht beschränkt auf, unsere Fähigkeit zur Finanzierung fortzusetzen und erfolgreich interne Forschungs- und Entwicklungsbemühungen Fortschritte und effektiv, wirtschaftlich tragfähige Drogen zu schaffen; unsere Fähigkeit, effektiv und rechtzeitig Verhalten klinischen Studien im Hinblick auf Kosten und Schwierigkeiten bei der Suche nach geeigneten Prüfzentren und bei der Aufnahme von Patienten zu erhöhen, die die Kriterien für bestimmte klinische Studien erfüllen; Risiken im Zusammenhang mit unserer Abhängigkeit von Drittanbieter-Dienstleister erfolgreich klinischen Studien innerhalb und außerhalb der Vereinigten Staaten durchzuführen; unsere Fähigkeit, die Profitabilität zu erreichen und zu halten und ausreichend flüssige Mittel zu erhalten; und unsere Fähigkeit zu gewinnen und zu erfahrenen Wissenschaftlern und Management behalten. Wir stellen diese Informationen vom 18. Mai 2016. Wir übernehmen keine Verpflichtung übernehmen, irgendwelche zukunftsgerichteten Aussagen zu aktualisieren, um das Auftreten von Ereignissen oder Umständen nach dem Datum dieser Aussagen oder erwarteter oder unerwarteter Ereignisse zu berücksichtigen, dass alle zugrunde liegenden Annahmen, solche Aussagen zu ändern .
KONTAKT:
§
Tricia Haugeto
§
(303) 386-1193
thaugeto@arraybiopharma.com
§
Logo - http://photos.prnewswire.com/prnh/20121029/LA02195LOGO
Um die ursprüngliche Version auf PR Newswire zu sehen, visit: http://www.prnewswire.com/news-releases/...esentations-300271179.html
Mit dem PR Newswire, 6. Juni 2016, 14.15.00 EDT
http://www.nasdaq.com/press-release/...se-3-nemo-study-20160606-00851
Binimetinib erreicht primären Endpunkt PFS in hohen ungedeckten Bedarf Patientenpopulation
Abstract No. 9500
BOULDER, Colo, 6. Juni 2016 / PRNewswire / - Array BioPharma. (Nasdaq: ARRY ) gab die vollständigen Ergebnisse an der 2016 American Society of Clinical Oncology (ASCO) in Chicago (Abstract Nr 9500) aus der Phase - 3 - NEMO (NRB Melanomen und MEK INHBITOR) -Studie von binimetinib. Die Studie fand heraus binimetinib deutlich verlängert mediane progressionsfreie Überleben (PFS), der primäre Endpunkt der Studie, bei 2,8 Monaten im Vergleich zu 1,5 Monate mit Dacarbazin beobachtet [Hazard Ratio (HR) = 0,62 (95% CI 0,47-0,80), p <0,001] - die erste Studie überhaupt ein PFS Endpunkt bei Patienten mit fortgeschrittenem NRB-mutierten Melanomen erfüllen. In der vorgegebenen Untergruppe von Patienten, die vor der Behandlung mit Immuntherapie, darunter Ipilimumab, nivolumab oder pembrolizumab erhalten, Patienten, die binimetinib 5,5 Monate von mediane PFS (95% CI, 2,8 bis 7,6) erlebt, verglichen mit 1,6 Monaten bei den in Behandlung mit Dacarbazin (95% CI, 1,5 bis 2,8).
"Die NEMO Ergebnisse sind vielversprechend und deuten darauf hin, binimetinib für die Tausenden von Patienten eine neue Behandlungsoption zur Verfügung stellen kann, die mit den NRB-Mutante Melanom diagnostiziert werden", sagte Studienleiter Reinhard Dummer
, MD, Professor, Abteilung für Dermatologie, Universität Zürich Hospital. "Besonders überzeugend sind die Ergebnisse in der vorgegebenen Untergruppe von Patienten, die vor der Behandlung mit Immuntherapie erhalten hatte, die nun als Standard der Versorgung für die First-Line-Behandlung bei dieser Patientenpopulation erkannt wird."
Darüber hinaus PFS zu verbessern, binimetinib zeigten auch signifikante Verbesserung der Gesamtansprechrate (ORR) und Krankheitskontrollrate (DCR). Zwar gibt es keinen statistisch signifikanten Unterschied im Gesamtüberleben gezeigt wurde, begünstigt das mediane Gesamtüberleben (MOS) die binimetinib Arm.
Bestätigt ORR betrug 15 Prozent (95% CI, 11 bis 20 Prozent) bei Patienten, die binimetinib gegenüber 7 Prozent (95% CI, 3-13 Prozent) bei Patienten, die Dacarbazin.
DCR für Patienten, die binimetinib betrug 58 Prozent (95% CI, 52-64 Prozent) gegenüber 25 Prozent (95% CI, 18-33 Prozent) für Patienten, die Dacarbazin.
mOS wurde bei 11,0 Monaten bei Patienten geschätzten Empfangs binimetinib vs. 10,1 Monate für mit Dacarbazin behandelten Patienten [(HR) = 1,0 (95% CI 0,75-1,33), p = 0,499].
"NRB-mutierten Melanomen Auswirkungen einer von fünf Patienten mit fortgeschrittenen Melanomen, doch gibt es noch keine Behandlungsmöglichkeiten angegeben speziell für diese Patienten", sagte Studienleiter Keith T. Flaherty
, MD, Direktor des Zentrums für Termeer Targeted Therapy, Massachusetts General Hospital und Professor of Medicine, Harvard Medical School. "Es bleibt ein Bedarf für zusätzliche wirksame Behandlungen für Patienten mit den NRB-Mutante Krankheit. Binimetinib für diese Patientenpopulation eine weitere wichtige Behandlungsoption zur Verfügung stellen können."
Binimetinib wurde im Allgemeinen gut vertragen und die Nebenwirkungen (AEs) berichtet, wurden im Einklang mit früheren Ergebnissen in NRB-Mutante Melanom-Patienten. Grad 3/4 AEs berichtet in mehr als oder gleich 5 Prozent der Patienten, die binimetinib enthalten erhöhte Kreatinphosphokinase (CPK) und Hypertonie.
"Die NEMO-Studie Ergebnisse das Potenzial von binimetinib zeigen langsame Fortschreiten der Erkrankung bei diesen Patienten zu helfen, ein oft übersehener Teilmenge ohne Behandlungsmöglichkeiten jenseits Immuntherapie", erklärte Victor Sandor
, MD, Chief Medical Officer, Array BioPharma. "Basierend auf der Stärke dieser Daten planen wir, unsere Zulassungsantrag für binimetinib in NRB-mutierten Melanomen noch in diesem Monat zu unterbreiten."
Über NEMO
Die NEMO-Studie (NCT01763164) ist eine internationale, randomisierte Phase-3-Studie bei Patienten mit fortgeschrittenem NRB-mutierten Melanomen. 402 Patienten wurden 2: 1 randomisiert und kontinuierlich 45 mg BID binimetinib oder 1000 mg / m 2 Dacarbazin alle drei Wochen verabreicht erhalten. Stand der Immuntherapie-Behandlung wurde erlaubt. Der primäre Endpunkt der Studie ist das progressionsfreie Überleben und das Gesamtüberleben ist ein wichtiger sekundärer Endpunkt. Die Patienten erhielten alle sechs Wochen, und Beurteilung der Progression röntgenologischen Beurteilung der Krankheitsstatus wurde durch geblendet zentrale Überprüfung festgestellt. Mehr als 100 Standorten in ganz Nordamerika, Europa, Südamerika, Asien und Australien teilgenommen in der Studie.
Über NRB-Mutant Melanom
Das Melanom ist die fünfthäufigste Krebsart bei Männern und die siebthäufigste Krebserkrankung bei Frauen in den Vereinigten Staaten, mit mehr als 76.000 neue Fälle und fast 10.000 Todesfälle durch die im Jahr 2016 ein- projizierten Krankheit NRB Mutationen sind in bis zu 20 Prozent Patienten mit metastasiertem Melanom, und ist ein schlechter für diese Patienten prognostischer Indikator. Die Behandlungsmöglichkeiten für diese Population bleiben über die Immuntherapie begrenzt, und die Patienten konfrontiert schlechte klinische Ergebnisse und eine hohe Sterblichkeit.
Über Binimetinib
MEK und BRAF sind wichtige Proteinkinasen in dem MAPK-Signalweg (RAS-RAF-MEK-ERK). Forschung hat gezeigt, dieser Weg mehrere wichtige Zellaktivitäten, einschließlich Proliferation, Differenzierung, Überleben und die Angiogenese reguliert. Unangemessenen Aktivierung von Proteinen in diesem Stoffwechselweg ist in vielen Krebsarten, wie Melanom, nicht-kleinzelligem Lungen-, Dickdarm- und Schilddrüsenkrebs auftreten gezeigt. Binimetinib ist ein Spätstadium Inhibitor kleines Molekül MEK, die Schlüsselenzyme in diesem Weg zum Ziel hat.
Binimetinib wird derzeit in Phase 3-Studien in fortgeschrittenen Krebspatienten untersucht, einschließlich der COLUMBUS-Studie encorafenib in Kombination mit binimetinib bei Patienten mit BRAF-mutierten Melanomen und dem kürzlich initiierten BEACON-Studie zu studieren, die encorafenib in Kombination mit binimetinib und Cetuximab bei Patienten untersuchen wird mit BRAF V600E-mutiertem Darmkrebs. Array-Projekte COLUMBUS Top-Line-Ergebnisse Verfügbarkeit im dritten Quartal 2016.
Über Array BioPharma
Array BioPharma Inc. ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Kommerzialisierung von gezielten, niedermolekulare Medikamente Patienten mit Krebs leidet, zu behandeln. Sechs Zulassungsstudien sind avanciert gegenwärtig im Zusammenhang mit drei Krebsmedikamente. Zu diesen Programmen gehören binimetinib (MEK162), encorafenib (LGX818) und selumetinib (Astrazeneca). Für weitere Informationen über Array, gehen Sie bitte auf www.arraybiopharma.com .
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen im Sinne des Private Securities Litigation Reform Act von 1995, einschließlich Aussagen über die zukünftigen Entwicklungspläne von binimetinib und encorafenib und den Zeitpunkt der Ankündigung weiterer Ergebnisse der klinischen Studien für binimetinib und encorafenib; Erwartungen, dass die Ereignisse, dass führen in größeren Wert für Array auftreten wird; und das Potential für die Ergebnisse der aktuellen und weitere klinische Studien zur Unterstützung der Zulassung oder den Markterfolg von binimetinib und encorafenib. Diese Aussagen beinhalten erhebliche Risiken und Unsicherheiten, einschließlich der in unserem jüngsten Jahresbericht auf Formblatt 10-K, in unseren Quartalsberichten eingereicht auf Formular 10-Q und in anderen Berichten von Array bei der Securities and Exchange Commission. Da diese Aussagen unsere gegenwärtigen Erwartungen bezüglich zukünftiger Ereignisse widerspiegeln, könnten unsere tatsächlichen Ergebnisse wesentlich von denen abweichen, die in diesen zukunftsgerichteten Aussagen als Ergebnis vieler Faktoren erwartet. Diese Faktoren umfassen, sind aber nicht beschränkt auf die Bestimmung durch die FDA, die aus klinischen Studien Ergebnisse sind nicht ausreichend Registrierung oder die Marktzulassung von binimetinib und encorafenib zu unterstützen; unsere Fähigkeit, effektiv und rechtzeitig Verhalten klinischen Studien im Hinblick auf Kosten und Schwierigkeiten bei der Suche nach geeigneten Prüfzentren und bei der Aufnahme von Patienten zu erhöhen, die die Kriterien für bestimmte klinische Studien erfüllen; Risiken im Zusammenhang mit unserer Abhängigkeit von Drittanbieter-Dienstleister erfolgreich klinischen Studien innerhalb und außerhalb der Vereinigten Staaten durchzuführen; unsere Fähigkeit, die Profitabilität zu erreichen und zu halten und ausreichend flüssige Mittel zu erhalten; und unsere Fähigkeit zu gewinnen und zu erfahrenen Wissenschaftlern und Management behalten. Wir stellen diese Informationen vom 6. Juni 2016. Wir übernehmen keine Verpflichtung übernehmen, irgendwelche zukunftsgerichteten Aussagen zu aktualisieren, um das Auftreten von Ereignissen oder Umständen nach dem Datum dieser Aussagen oder erwarteter oder unerwarteter Ereignisse zu berücksichtigen, dass alle zugrunde liegenden Annahmen, solche Aussagen zu ändern .
KONTAKT:
§
Tricia Haugeto
§
(303) 386-1193
thaugeto@arraybiopharma.com
§
Logo - http://photos.prnewswire.com/prn/20121029/LA02195LOGO
Um die ursprüngliche Version auf PR Newswire zu sehen, visit: http://www.prnewswire.com/news-releases/...-nemo-study-300279853.html
SOURCE Array BioPharma
Array Biopharma Incorporated (NASDAQ:ARRY) Shorts Decreased by 5.96% After Short Covering
by Post Staff Writer — June 21, 2016