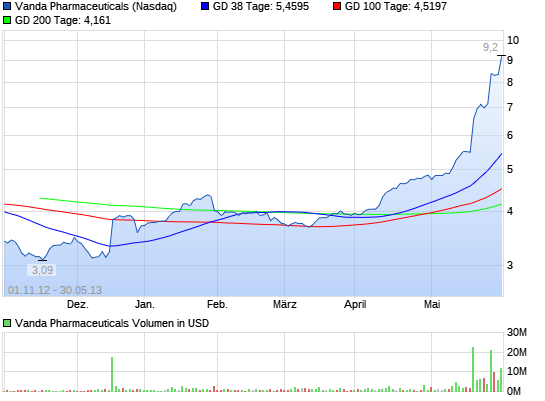
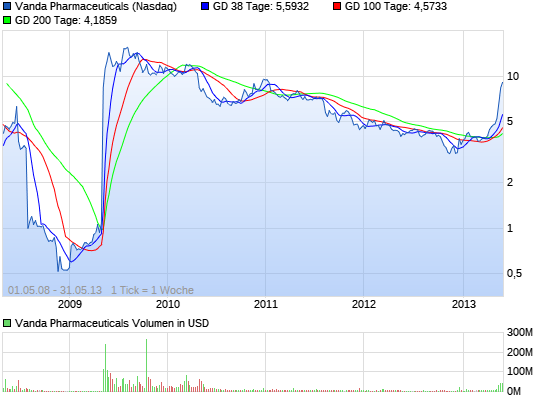
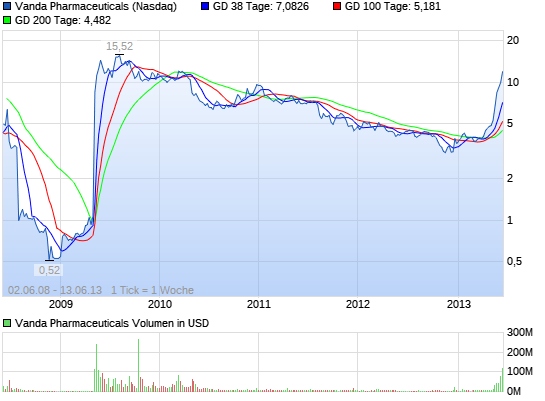
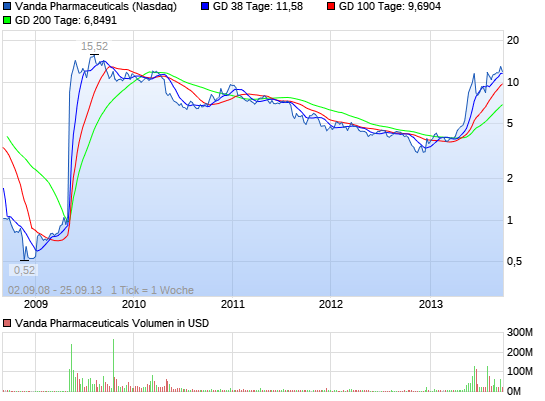
VANDA PHARMACEUTICALS rebound ?
http://finance.yahoo.com/news/...ng-largest-percentage-174218904.html
Top 10 Nasdaq-Aktien gehandelt Entsendung größten prozentualen Steigerungen
NEW YORK (AP) - Ein Blick auf die 10 größten prozentualen Gewinnern an der Nasdaq um 1 Uhr:
National Research B stieg um 14,2 Prozent auf 34,80 $.
YRC Worldwide Inc. stieg um 12,0 Prozent auf 20,28 $.
Alliance Healthcare Services Inc. stieg um 11,9 Prozent auf $ 15.15.
Southcoast Financial Corp stieg um 11,6 Prozent auf 5,59 $.
Avago Technologies stieg um 10,6 Prozent auf 38,10 $.
American Independence Corp stieg um 9,3 Prozent auf 7,65 $.
Vanda Pharmaceuticals Inc. stieg um 8,9 Prozent auf 9,08 $.
China HGS Real Estate Inc. stieg um 8,4 Prozent auf 7,77 $.
AcelRx Pharmaceuticals Inc. um 8,4 Prozent auf $ 9,00.
Silver Standard Resources Inc. um 8,1 Prozent auf $ 8.23.
http://www.ariva.de/news/...-III-Data-at-Two-Medical-Meetings-4545937
2.35 31.05.13
PR Newswire
WASHINGTON, 30. Mai 2013
WASHINGTON, 30. Mai 2013 / PRNewswire / - Vanda Pharmaceuticals Inc. (VANDA) (NASDAQ: VNDA) gab heute bekannt, dass Daten aus den Phase-III-Studien von tasimelteon in Nicht-24-Stunden-Disorder (Non-24) vorgestellt SLEEP 2013, dem 27. Jahrestagung der assoziierten Professional Sleep Societies, wobei LLC ab dem 1. Juni 2013 bis 5. Juni 2013 in Baltimore statt und der Gesellschaft für Endokrinologie 95. Jahrestagung (ENDO) gehalten 15. Juni 2013 bis Juni 18, 2013 in San Francisco. Non-24 ist eine schwere und seltene Störung des Tagesrhythmus, die eine Mehrheit der Personen, die völlig blind Lichtperzeption fehlt und kann nicht mitzureißen (synchronisieren) ihren Meister innere Uhr auf die 24-Stunden-Tag betrifft.
Tasimelteon Daten SLEEP 2013 als Late Breaking Abstract und die Daten an ENDO 2013 in einem Plakat und mündlichen Präsentation vorgestellt werden vorgestellt. Die Darstellung der Daten Zeitplan ist wie folgt:
- SLEEP 2013 Baltimore
Late Breaking Abstract # 005 5. Juni 2013 um 12:15 Uhr-1: 30 Uhr
- ENDO 2013 San Francisco
SUN-134 16. Juni 2013 um 13.45 Uhr bis 03.45 Uhr
SUN-137 16. Juni 2013 um 13.45 Uhr bis 03.45 Uhr
Über Nicht-24-Stunden-Disorder
Non-24 ist eine schwere, seltene und chronische Störung des Tagesrhythmus durch die Unfähigkeit, mitzureißen (synchronisieren) der Master innere Uhr mit dem 24-Stunden-Tag-Nacht-Zyklus gekennzeichnet. Non-24 betrifft die Mehrheit der völlig blind Individuen oder zwischen 65.000 und 95.000 Menschen in den USA Nicht-24 tritt fast ausschließlich bei Personen, die die Lichtempfindlichkeit notwendig mitzureißen Master innere Uhr im Gehirn mit der 24-Stunden-Tag fehlt Nacht-Zyklus. Die meisten Menschen haben einen Master innere Uhr, die natürlich länger läuft als 24-Stunden-und Licht ist die primäre Umwelt Fingerzeig, dass setzt ihn auf 24 Stunden pro Tag. Personen mit dem Non-24 eine Master innere Uhr, die ständig Verzögerungen, was längere Versatz zwischen ihren Tagesrhythmus und der 24-Stunden-Tag-Nacht-Zyklus, einschließlich des Zeitpunkts von Melatonin und Cortisol-Sekretion und den Schlaf-Wach-Zyklus. Als Ergebnis dieser Versatz, Nicht-24 mit erheblichen Beeinträchtigungen der sozialen und beruflichen Funktionsfähigkeit und deutliche subjektive Not verbunden. Für weitere Informationen über Nicht-24, besuchen Sie bitte www.non-24.com .
Über Tasimelteon
Tasimelteon ist eine zirkadiane Regler in der Entwicklung für die Behandlung von Non-24. Tasimelteon ist ein Dual-Melatonin-Rezeptor-Agonisten (DMRA) mit selektiver Agonist Aktivität an den MT1 und MT2-Rezeptoren. Tasimelteon Fähigkeit, die innere Uhr Master in der suprachiasmatischen Nukleus (SCN) Ergebnisse bei der Mitnahme des körpereigenen Melatonin und Cortisol Rhythmen mit der 24-Stunden-Tag-Nacht-Zyklus zurückgesetzt. Das Patent behauptet tasimelteon als eine neue chemische Einheit erstreckt sich bis Dezember 2022, unter der Annahme einer 5-Jahres-Verlängerung unter dem Hatch-Waxman Act gewährt werden. Tasimelteon wurde Orphan Drug Designation zur Behandlung von Non-24 aus den USA und der Europäischen Union gewährt.
Über Vanda Pharmaceuticals Inc.:
Vanda Pharmaceuticals Inc. ist ein biopharmazeutisches Unternehmen auf die Entwicklung und Vermarktung von Produkten für die Behandlung von Erkrankungen des zentralen Nervensystems fokussiert. Weitere Informationen über Vanda, besuchen Sie bitte www.vandapharma.com .
Kontakt zum Unternehmen:
Jim Kelly
Senior Vice President und Chief Financial Officer
Vanda Pharmaceuticals Inc.
(202) 734-3428
jim.kelly @ vandapharma.com
Kontakt für die Medien:
Laney Landsman
Assistant Vice President
Makowski
(212) 508-9643
llandsman@makovsky.com
SOURCE Vanda Pharmaceuticals Inc.
Quelle: PR Newswire
alles Gute! viele solidarische Helfer unterwegs dieser Tage!
Gruß
§
Date Event Reminder §
7-Nov-13§Vanda Pharmaceuticals Inc. Earnings Call scheduled for 10:00 am ET today Set a Reminder
7-Nov-13§Earnings announcement Set a Reminder
7-Nov-13§VANDA PHARMACEUTICALS INC. Files SEC form 8-K, Results of Operations and Financial Condition, Financial Statements an Set a Reminder
http://finance.yahoo.com/q/ce?s=VNDA+Company+Events
Allerdings könnte das bevorstehende Ereigniss das Chart Bild umkehren.
WASHINGTON, 16. Oktober 2013 / PRNewswire / - Vanda Pharmaceuticals Inc. (VANDA) (NASDAQ: VNDA) gab heute bekannt, dass die US Food and Drug Administration (FDA) hat die Gesellschaft von der Planung einer peripheren und zentralen Nervensystem mitgeteilt Drugs Advisory Committee Meeting am 14. November 2013, für die Überprüfung der New Drug Vanda Application (NDA) für tasimelteon, vorgesehener Handelsname HETLIOZ ', für die Behandlung von Nicht-24-Stunden-Disorder (Non-24) in der völlig blind. Vanda tasimelteon NDA wird derzeit Priority Review durch die FDA mit einer Aktion unter dem Zieldatum Prescription Drug User Fee Act (PDUFA-V) vom 31. Januar 2014
http://phx.corporate-ir.net/...sArticle&ID=1873600&highlight=
WASHINGTON , 7. November 2013 / PRNewswire / - Vanda Pharmaceuticals Inc. (Vanda) (NASDAQ: VNDA), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung von Produkten für die Behandlung von Erkrankungen des zentralen Nervensystems konzentriert, gab heute bekannt, finanziellen und operativen Ergebnisse für das dritte Quartal 30. September 2013 .
Key Highlights:
Auf 29. Juli 2013 Vanda angekündigt, dass die US Food and Drug Administration ( FDA ) Akzeptiert die Einreichung und gewährte eine vorrangige Prüfung Klassifizierung nach New Drug Application Vanda (NDA) für tasimelteon eine zirkadiane Regler für die Behandlung von Nicht-24-Stunden-Disorder (Non-24) in der völlig blind.
Die FDA geplant ist eine periphere und zentrale Nervensystem Drugs Advisory Committee Meeting auf 14. November 2013 , Für die Überprüfung der NDA für Vanda tasimelteon, vorgesehener Handelsname HETLIOZ ™ zur Behandlung von Non-24.
Die FDA bestimmt die Aktion Zieldatum unter dem Prescription Drug User Fee Act (PDUFA-V) für tasimelteon zu sein 31. Januar 2014.
Auf 7. August 2013 Vanda abgeschlossen das öffentliche Angebot von 4.680.000 Aktien der Stammaktien resultierende Nettoerlös von $ 48.600.000 .
Vanda erzielte im dritten Quartal 2013 einen Umsatz von $ 8.700.000 einschließlich Lizenzgebühren von 2,0 Millionen Dollar . Fanapt ® Rezepte, wie durch IMS berichtet, waren etwa 43.600 für das dritte Quartal 2013. Dies entspricht einem Anstieg von 13% im dritten Quartal 2012 über Rezepte und ein Anstieg von 5% gegenüber dem zweiten Quartal 2013 Rezepte.
DRITTE QUARTAL Jahr 2013 gemeldeten ERGEBNISSE
Der Gesamtumsatz für das dritte Quartal 2013 waren $ 8.700.000 , Im Vergleich zu $ 8.300.000 für den gleichen Zeitraum im Jahr 2012. Drittes Quartal 2013 Umsatzerlöse enthalten 2,0 Millionen Dollar in Fanapt ® erhielt von Lizenzgebühren Novartis um Lizenzgebühren im Vergleich $ 1.500.000 für das dritte Quartal des Jahres 2012.
Die betrieblichen Aufwendungen für das dritte Quartal des Jahres 2013 waren $ 14.100.000 , Im Vergleich zu $ 13.700.000 für das dritte Quartal des Jahres 2012. Drittes Quartal 2013 Forschungs-und Entwicklungskosten in Höhe von 8,0 Mio. USD beinhaltet $ 3.500.000 Meilensteine in mit dem zugehörigen FDA Annahme der tasimelteon Einreichung. Der primäre Treiber der unteren Forschung und Entwicklung betrugen im dritten Quartal 2013 im Vergleich zu $ 10.200.000 im dritten Quartal 2012 war die Fertigstellung der tasimelteon Non-24 und Major Depressive Disorder Wirksamkeitsstudien. Allgemeine und Verwaltungskosten $ 5.700.000 für das dritte Quartal des Jahres 2013 waren $ 2.600.000 höher als im dritten Quartal 2012 und beziehen sich auf die erhöhte Handelstätigkeit in Vorbereitung einer potenziellen Markteinführung in tasimelteon die Vereinigten Staaten .
Vanda verzeichnete einen Nettoverlust von $ 5.400.000 für das dritte Quartal des Jahres 2013 mit einem Nettoverlust von im Vergleich $ 5.300.000 für den gleichen Zeitraum im Jahr 2012. Das verwässerte Ergebnis je Aktie für das dritte Quartal 2013 war 0,17 $ , Verglichen mit einem verwässerten Verlust je Aktie von 0,19 $ für das dritte Quartal des Jahres 2012.
Liquide Mittel und Wertpapiere des Umlaufvermögens (Bargeld) erhöht $ 38.500.000 auf 142.200.000 $ Stand 30. September 2013 , Vor allem aufgrund des Verkaufs von Stammaktien in öffentlichen Angebots Vanda im August 2013.