Gilead Sciences mit starken Zahlen ! WKN : 885823
Gilead Sciences, Inc. (Nasdaq: GILD) hat heute bekannt gegeben, dass sein Board of Directors (Vorstand) einen Aktiensplit der ausstehenden Stammaktien des Unternehmens im Verhältnis 2 zu 1 genehmigt hat, der durch eine Aktiendividende ausgeführt werden soll. Aktionäre zum Geschäftsschluss am 7. Januar 2013 haben Anspruch auf eine Aktiendividende in Höhe von einer zusätzlichen Stammaktie für jede Stammaktie, die sie besitzen. Auf Grundlage der Gesamtanzahl ausstehender Stammaktien zum 30. November 2012 wird der Aktiensplit die Gesamtanzahl ausstehender Stammaktien von etwa 759.335.932 auf 1.518.671.864 erhöhen. Aktuell sind 2.800.000.000 Stammaktien genehmigt.
Die Transferstelle des Unternehmens, Computershare Shareowner Services LLC, wurde angewiesen, Aktionären, die ihre Aktienzertifikate physisch in ihrem Besitz haben, am 25. Januar 2013 für die zusätzlichen Aktien eine Mitteilung der direkten Registrierung der Transaktion (Direct Registration Transaction Advice) zu senden. Aktionäre, die ihre Aktien in einem Depotkonto halten, erhalten ihre neuen Aktien am gleichen oder um das gleiche Datum über ihren Makler und Händler.
Die Aktien des Unternehmens werde ab dem 28. Januar 2013 zu ihrem Preis nach dem Aktiensplit gehandelt. Aktien, die nach dem 7. Januar 2013 und bis zum 28. Januar 2013 gekauft werden, werden mit einer Verpflichtungserklärung bereitgestellt, die dem Käufer Anspruch auf eine zusätzliche Aktie für jede gekaufte Aktien erteilt.
http://www.live-pr.com/...ad-genehmigt-aktiensplit-im-r1049843156.htm
Gilead Sciences - Kürzel: GILD - ISIN: US3755581036
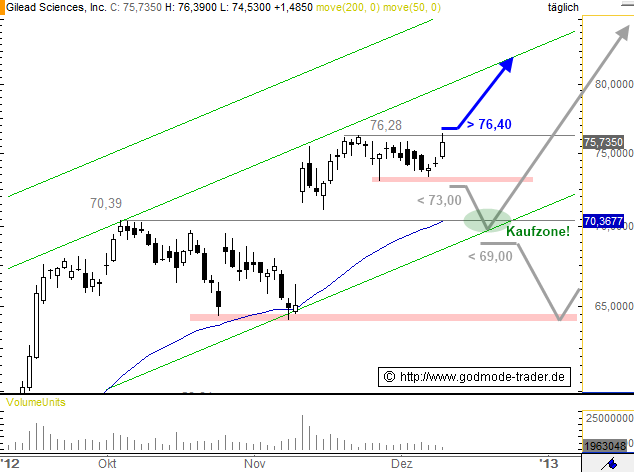
Börse: Nasdaq in USD / Kursstand: 75,735 $
Die Gilead Sciences Aktie attackiert heute nach mehrtägiger Seitwärtsbewegung das Allzeithoch bei 76,28 $ und steigt intraday auch kurz darüber an, kippt jetzt aber wieder zurück. Erst wenn es per Stunden- und Tagesschluss auch über 76,40 $ geht, wäre der Weg frei bis 81,40 - 82,60 $. Später liegt bei etwa 90,00 das nächste Ziel.
Unterhalb von 73,00 per Tagesschluss wären hingegen nochmals Korrekturen zur Kreuzunterstützung und damit potenziellen Kaufzone bei 69,50 - 71,10 $ möglich. Erst ein Rückfall per Tagesschluss unter 69,00 $ würde eine Verkaufsignale bringen und Abwärtsbewegung bis 64,00 - 64,70 ermöglichen.
Kursverlauf vom 14.09.2012 bis 11.12.2012 (log. Kerzendarstellung / 1 Kerze = 1 Tag)
"http://www.godmode-trader.de/nachricht/Gilead-Sciences-Willkommen-am-Allzeithoch,a2986300.html
http://wallstcheatsheet.com/stocks/...asdaq-healthcare-biz-wrap.html/
New York (BoerseGo.de) - Das Biotechnologie-Unternehmen Gilead Sciences wird YM BioScienses zu einem Kaufpreis von rund 510 Millionen US-Dollar übernehmen. Laut MarketWatch wird Gilead Sciences dabei 2,95 US-Dollar pro Aktie in bar bezahlen Der Aufschlag gegenüber dem gestrigen Schlusskurs bei YM BioScienses von 1,63 US-Dollar je Aktie liegt somit bei 79,76 Prozent. Die Transaktion wird voraussichtlich im ersten Quartal des nächsten Jahres abgeschlossen werden. Die Aktien von YM BioSciences haben im vorbörslichen Handel heute rund 79 Prozent zugelegt.
http://www.finanznachrichten.de/...ces-fuer-510-millionen-usd-009.htm
Truvada (emtricitabine/tenofovir disoproxil fumarate) was approved for prophylaxis to reduce the risk of HIV-1 infection in adults.
The FDA approved Gilead Sciences, Inc’s Truvada (emtricitabine 200 mg/tenofovir disoproxil fumarate 300 mg) in combination with safer sex practices for pre-exposure prophylaxis (PrEP) to reduce the risk of sexually acquired HIV-1 in adults at high risk.
High-risk patients include those with a partner known to be infected with HIV-1 or those who engage in sexual activity within an area of high HIV-1 prevalence and have 1 or more of following characteristics: inconsistent or nonexistent condom use, diagnosis of sexually transmitted infections, exchange of sex for commodities (such as money, food, shelter, or drugs), use of illicit drugs or alcohol dependence, incarceration, or partner(s) of unknown HIV-1 status with any of the previous risk factors.1
In 2004, Truvada was approved for treatment of HIV-1 infection in combination with other antiretroviral agents in patients 12 years and older. It is the first agent to be approved for PrEP.2,3
Pharmacology and Pharmacokinetics
Emtricitabine and tenofovir are nucleoside analogue HIV-1 reverse transcriptase inhibitors. Race did not affect the pharmacokinetics of emtricitabine. Data are insufficient to determine impact of race on the pharmacokinetics of tenofovir disoproxil fumarate. Gender does not affect the pharmacokinetics of Truvada. Truvada should not be used in patients younger than 12 years or weighing less than 35 kg. The pharmacokinetics of patients older than 65 years has not been fully evaluated.1
Dosage and Administration
When given to HIV-1 uninfected adults for the indication of PrEP, Truvada should be dosed as 1 tablet orally each day taken with or without food. Truvada should not be used in uninfected HIV-1 patients with a creatinine clearance (CrCl) below 60 mL/min. If CrCl decreases during treatment, potential causes should be evaluated and the risks and benefits of continued use should be reassessed.1
Clinical Trials
The safety and efficacy of Truvada for PrEP was evaluated in 2 randomized, double-blind, placebo-controlled trials. The iPrEx trial evaluated Truvada in 2499 HIVnegative men or transgender women who had sex with men and evidence of other high-risk behavior. Compared with placebo, the study found that Truvada reduced the risk of HIV infection by 42% and that efficacy was strongly correlated to medication adherence.
The Partners PrEP trial evaluated 4758 heterosexual couples where one partner was HIV infected and the other was not. The study found Truvada reduced the risk of infection by 75% compared with placebo.3
Contraindications, Warnings, and Precautions
Truvada carries the following boxed warning:
- Lactic acidosis and severe hepatomegaly with steatosis, including fatal cases, have been reported during treatment with nucleoside analogues, including tenofovir.
- Truvada is not approved for the treatment of chronic hepatitis B virus (HBV) infection. Severe acute exacerbations of HBV have been reported in patients with both HIV-1 and HBV who have discontinued Truvada. Hepatic function should be closely monitored in these patients, and in some cases, anti–hepatitis B treatment may be necessary.
- When used for PrEP, Truvada must be prescribed only to patients who are confirmed to be HIV-negative immediately prior to initiation of treatment and periodically throughout its use. If signs or symptoms of HIV-1 infection are present, treatment with Truvada should not be initiated until negative infection status is obtained.
The use of Truvada for PrEP is contraindicated in patients with an unknown or positive HIV-1 status. When used in HIV-infected patients, Truvada should only be used in combination with other antiretroviral agents.
New onset or worsening renal failure has been reported. Do not use Truvada with other agents that contain either emtricitabine or tenofovir. Bone mineral density should be monitored. Body fat may accumulate or be redistributed during treatment with Truvada. Immune reconstitution syndrome has been reported. When used for PrEP, Truvada should be used as only part of a comprehensive strategy that includes other prevention methods, such as safer sex practices, as Truvada alone is not always effective in preventing HIV-1 infection. All uninfected patients should be counseled regarding strict adherence to Truvada therapy.
http://www.pharmacytimes.com/publications/issue/...ences-Incs-Truvada
ist denn heute passiert,dass die Aktie um fast 50% nachgegeben hat?
Wer weiss was?
Sollte man sie jetzt kaufen?
Im " Aktionär" wird sie als konservativer Top-Tipp empfohlen.
Das bedeutet Verdoppelung der Aktien, jedoch Werterhalt. Aktie startet ab heute auf dem niedrigeren Preisniveau und kann sich wieder hoch schaffen.
eine Freude, solch eine Aktie im Depot zu haben ...
wie man sieht interessiert es in Deutschland aber kaum jemanden , das es US Unternehmen gibt, die seit Jahren so hervoragend arbeiten...
ich beobachte die Aktie schon einige zeit, bin leider bei 29,00 Euro nicht eingestiegen und warte nur auf eine Korrektur, zumindest hoffe ich mal das eine kommt. Was für Aktien aus den USA würdet ihr noch empfehlen?
Ich bin 2008 Eingestiegen, weil die Ergebnisse berauschend waren. Seitdem waren die Ergebnisse immer noch super, aber der Kurs lief seitwärts. Mittlerweile bin ich 100 Prozent im Plus und hab erstmal meinen Einsatz wieder rausgenommen. Der Gewinn darf jetzt die nächsten 100 Prozent bringen.
Kurzfristig macht mir das KGV über 20 etwas sorgen. Wenn das Wachstum aber passt, könnte das für eine Weile auch so hoch bleiben.
Hallo zusammen,
ich habe schon länger darüber nachgedacht, Aktien von Gilead zu kaufen. Bislang habe ich abgewartet, aber nachdem der Aktiensplit vollzogen ist und ich auch fast nur positives über die Aktie und das Unternehmen selbst gelesen habe, denke ich jetzt vermehrt darüber nach, vor allem auch, da der Kurs jetzt doch wieder etwas nachgegeben hat.
KGV ist relativ hoch, aber wenn das Wachstumspootential sich einmal Bahn bricht, ist es jetzt vielleicht doch der richtige Zeitpunkt. Was meint ihr: besser noch etwas abwarten oder jetzt einsteigen?
LG,
Black Knight.
Was sagt Ihr dazu das die Aktie seit 2 Wochen nur noch am fallen ist.
Meint Ihr da gibt es bald mal eine Trendwende?
Von einer Trendwende würde ich jetzt sicher noch nicht sprechen.
Gilead weist einen sehr schönen und sauberen markttechnischen Trend auf (steigende Hochs u. steigende Tiefs) der Kurs ist auch noch meilenweit von seiner 200 Tage Linie entfernt.
Die aktuell laufende Konsolidierung hat noch nicht einmal das 50er Retracement der letzten Bewegung erreicht. Außerdem fand diese kleine Korrektur unter abnehmenden Volumen statt, im Gegensatz zu dem vorhergehenden Aufwärtsswing. Ein gutes Zeichen...Volume goes with Trend !
Desweiteren hat der Money-Flow Index wieder die uberverkaufte Zone verlassen.
Wer sicher gehen will wartet bis der Money-Flow seine Mittellinie überspringt und der Kurs den 20GD schneidet.
Was glaubt ihr in welche Richtung es hier weiter geht?
Wo seht ihr die mittelfristige Grenze für Gilead??
zurück ..Sa, 18.01.14 17:21
– Sovaldi für Verwendung bei Genotyp 1-6 zugelassen –
– Hohe Heilungsraten und auf zwölf Wochen verkürzte Therapiezeit für nicht vorbehandelte („behandlungsnaive“) Patienten –
– Erste vollständig oral zu verabreichende Behandlungsmöglichkeit für Patienten, bei denen Interferon nicht infrage kommt –
– Erstes Arzneibehandlungsschema für Patienten vor Lebertransplantationen zur Vermeidung von HCV-Rezidiven –
Gilead Sciences, Inc. (NASDAQ:GILD) hat heute bekannt gegeben, dass die Europäische Kommission die Marktzulassung für Sovaldi® (Sofosbuvir) 400-mg-Tabletten erteilt hat, einem einmal täglich oral einzunehmendem Nukleotid-analogen Polymerase-Inhibitor zur Behandlung von chronischer Hepatitis C (CHC) bei Erwachsenen in Kombination mit anderen antiviralen Wirkstoffen (Ribavirin (RBV) und pegyliertem Interferon alpha (peg-IFN). Die heute erteilte Marktzulassung folgt auf ein beschleunigtes Beurteilungsverfahren durch die Europäische Arzneimittelagentur, eine Erlaubnis, die neuen Medikamenten von großem öffentlichen Gesundheitsinteresse gewährt wird und die Markteinführung von Sovaldi in allen 28 Staaten der Europäischen Union (EU) gestattet.
Sovaldi wurde bei Patienten mit den Hepatitis C-Viren (HCV) der Genotypen 1-6 untersucht. Die Wirksamkeit von Sovaldi wurde bei Patienten mit den Genotypen 1-4, bei Patienten, die vor einer Lebertransplantation stehen und bei Patienten, die eine HCV/HIV-1 Koinfektion haben, gezeigt. Die klinischen Daten, die die Anwendung von Sovaldi bei Patienten mit den Genotypen 5 und 6 unterstützen, sind begrenzt. Empfohlen werden folgende Arzneibehandlungsschema und folgende Behandlungszeiträume für Sovaldi-Kombinationstherapien bei nur mit HCV infizierten oder mit HCV/HIV-1 koinfizierten Patienten:
„Im Gegensatz zu vielen anderen chronischen Erkrankungen, kann Hepatitis C geheilt werden. Allerdings konnte bei vielen HCV-Patienten aus einer Vielzahl an Gründen derzeit noch keine Heilung erreicht werden und daher entwickeln sich dann häufig Lebererkrankungen oder Leberkarzinome im Endstadium“, sagte Dr. Graham Foster, Professor für Hepatologie an der Queen Mary University of London. „Die hohen Heilungsraten bei einer großen Zahl an Patienten und die kurze Dauer der Therapie machen Sovaldi zu einem sehr begrüßungswerten therapeutischen Fortschritt, der die Anzahl der Patienten erhöhen wird, die behandelt und schließlich geheilt werden können.
Ungefähr neun Millionen Menschen in Europa sind mit HCV infiziert, die eine Hauptursache für Leberkarzinome und -transplantationen sind. Die gesellschaftliche, klinische und wirtschaftliche Belastung durch unbehandelte HCV ist beträchtlich und die durch HCV verursachten Gesundheitskosten sind direkt verbunden mit der Schwere der Krankheit. Die derzeitige standardmäßige Behandlung von HCV umfasst bis zu 48 Wochen Therapie mit einem peg-IFN/RBV enthaltendem Arzneibehandlungsschema, das für bestimmte Patiententypen nicht geeignet ist.
„Die Marktzulassung von Sovaldi ist ein wichtiger Schritt nach vorn bei der Behandlung von Hepatitis C in Europa, da viel mehr Patienten eine Aussicht auf Heilung bekommen“, sagte Dr. John C. Martin, Chairman und CEO von Gilead Sciences. „Unser angestrebtes Ziel ist es, mit den einzelnen Regierungen und Gesundheitssystemen zusammenzuarbeiten, damit Sovaldi so schnell wie möglich in Europa verfügbar ist.“
Die Marktzulassung durch die Europäische Kommission für Sovaldi wird hauptsächlich mit Daten aus vier Phase-3-Studien gestützt: NEUTRINO, FISSION, POSITRON und FUSION. In diesen Studien wurde festgestellt, dass eine 12- oder 16-wöchige Therapie auf Sovaldi-Grundlage den derzeit zur Verfügung stehenden Behandlungsoptionen oder historischen (Langzeit-) Kontrollen überlegen oder nicht unterlegen war. Diese Ergebnisse gründen sich auf den Anteil der Patienten, die zwölf Wochen nach Therapieabschluss (SVR12) ein anhaltendes virologisches Ansprechen (HCV nicht feststellbar) zeigten. Patienten, bei denen SVR12 erreicht wird, werden als von HCV geheilt betrachtet. Patienten der Studie, die eine Therapie auf Sovaldi-Grundlage erhalten, erreichen SVR12-Raten von 50-90 Prozent. Einzelheiten zu der Studie finden Sie in der Zusammenfassung der Produkteigenschaften unter www.ema.europa.eu.
Während des regulatorischen Zulassungsverfahrens wurden Daten aus zwei zusätzlichen Phase-3-Studien, VALENCE und PHOTON-1, zum Antrag auf Marktzulassung hinzugefügt. In der VALENCE-Studie wurden Patienten mit einer HCV-Infektion des Genotyps 3 während 24 Wochen mit Sovaldi und RBV behandelt. In der PHOTON-1-Studie wurden Sovaldi und RBV zwölf Wochen lang bei Patienten mit einer HCV-Infektion vom Genotyp 2, die mit HIV-1 koinfiziert waren, untersucht, und 24 Wochen lang bei Patienten mit einer HCV-Infektion vom Genotyp 1, die mit HIV-1 koinfiziert waren. In sämtlichen Phase-3-Studien von Sovaldi wurde bei Patienten, die nach Abschluss der Therapie einen Rückfall erlitten, keine Virusresistenz gegen das Medikament festgestellt.
Bisher haben fast 3.000 Patienten bei Studien der Phase 2 oder 3 mindestens eine Dosis Sovaldi erhalten. Sovaldi wurde bei klinischen Studien gut toleriert. Die Nebenwirkungen waren allgemein mild und gaben wenig Anlass zu Behandlungsabbrüchen. Die häufigsten unerwünschten Ereignisse, die bei mindestens zehn Prozent der Patienten auftraten, entsprachen den Sicherheitsprofilen von peg-IFN und RBV. Darunter waren Müdigkeit, Kopfschmerzen, Übelkeit, Schlaflosigkeit, Schwindel, Pruritus (starker Juckreiz) und Anämie.
Sovaldi wurde am 6. Dezember 2013 in den USA und am 13. Dezember 2013 in Kanada zugelassen. Zulassungsanträge wurden auch in Australien, Neuseeland, der Schweiz und der Türkei eingereicht.
Über Gilead Sciences
Gilead Sciences ist ein Biopharmaunternehmen, das innovative Arzneimittel für medizinische Bereiche erforscht, entwickelt und vermarktet, in denen ungedeckter Bedarf besteht. Das Unternehmen hat es sich zur Aufgabe gemacht, die Versorgung lebensbedrohlich erkrankter Patienten weltweit voranzutreiben. Gilead hat seinen Hauptsitz im kalifornischen Foster City und besitzt weitere Niederlassungen in Nord- und Südamerika, in Europa und im asiatisch-pazifischen Raum.